题目内容
8.将10mL0.5mol/L NaOH 溶液,加水稀释到100mL,稀释后溶液中NaOH 的物质的量浓度为( )| A. | 0.05 mol/L | B. | 0.01 mol/L | C. | 0.02 mol/L | D. | 0.03 mol/L |
分析 将10mL0.5mol/L NaOH 溶液加水稀释到100mL,稀释过程中溶质氢氧化钠的物质的量不变,根据c=$\frac{n}{V}$计算出稀释后溶液中NaOH 的物质的量浓度.
解答 解:将10mL0.5mol/L NaOH 溶液加水稀释到100mL,稀释过程中NaOH的物质的量不变,
则稀释后溶液中NaOH 的物质的量浓度为:c(NaOH)=$\frac{0.5mol/L×0.01L}{0.1L}$0.05mol/L,
故选A.
点评 本题考查了溶液稀释的计算,题目难度不大,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
14.NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300KJ/mol 当有5NA个电子转移时能放出650KJ的热量 | |
| B. | 有28g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 有反应H2(g)+I2(g)?2HI(g)△H=-QHJ/mol在298K 101KPa下向一密闭容器中充入NA个H2和NA个I2,充分反应共放出热量为QKJ | |
| D. | 在78g苯中含3NA个碳碳双键 |
13.HA与醋酸酸性相似,下列叙述错误的是( )
| A. | HA水溶液中微粒浓度大小顺序:c(HA)>c(H+)>c(A-)>c(OH-) | |
| B. | NaA水溶液中:c(Na+)═c(A-)+c(HA) | |
| C. | HA与NH3作用生成的化合物是共价化合物 | |
| D. | 稀释0.1mol/LHA水溶液,其电离程度增大,pH也增大 |
17.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 0.1mol的CaC2中含阴离子数是0.1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO${\;}_{3}^{-}$和CO${\;}_{3}^{2-}$离子数之和为0.1NA |
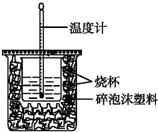 (1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: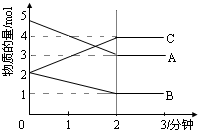 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: