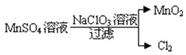
题目内容
6.某溶液中含有Na+、Mg2+、Cl-、SO42-四种离子,已知Na+为0.2mol,Mg2+为0.4mol,Cl-为0.4mol,则SO42-物质的量为( )| A. | 5mol | B. | 0.3mol | C. | 0.5mol | D. | 0.2mol |
分析 溶液遵循电荷守恒,则阳离子的电荷总数等于阴离子的电荷总数,以此来解答.
解答 解:设SO42-物质的量为x,Na+为0.2mol,Mg2+为0.4mol,Cl-为0.4mol,
由电荷守恒可知,
0.2×1+0.4×2=0.4×1+x×2,
解得x=0.3mol,
故选B.
点评 本题考查物质的量的计算,为高频考点,把握电荷守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
相关题目
13.下列反应中.既属于氧化还原反应同时又是吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 灼热的碳与高温水蒸气的反应 | ||
| C. | 铝与稀盐酸 | D. | H2与O2的燃烧反应 |
11.某溶液与金属铝反应能放出氢气,则在该溶液中一定能大量共存的离子组是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | NO3-、K+、Cl-、Na+ | D. | HCO3-、K+、NO3-、Al3+ |
1.常温时,以下4种溶液pH最小的是( )
| A. | 0.01mol•L-1醋酸溶液 | |
| B. | 0.02mol•L-1醋酸与0.02mol•L-1NaOH溶液等体积混合液 | |
| C. | 过量CO2通入到0.01mol•L-1NaOH溶液后所得溶液 | |
| D. | pH=2的盐酸与pH=12的NaOH溶液等体积混合液 |
11.已知:①A+B2+═A2++B ②D+2H2O═D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-═B2+,下列说法正确的是( )
| A. | 氧化性:E2+>B2+>A2+>D2+ | |
| B. | 氧化性:D2+>E2+>A2+>B2+ | |
| C. | 反应E+A2+=A+E2+能够进行 | |
| D. | 提取某废水中含有少量的A2+时可以选用D |
18.对下列反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O 判断合理的是( )
| A. | Fe(NO3)x中的x为3 | |
| B. | 标准状况下产生4.48LNO,就有0.6 mol 电子转移 | |
| C. | 稀HNO3 在反应中只作氧化剂 | |
| D. | 磁性氧化铁中的铁元素全部被氧化 |
15.下列说法中正确的是( )
| A. | 2 mol CH4的质量和O2的摩尔质量都是32g | |
| B. | 1 mol任何气体中都含有相同的原子数 | |
| C. | 1 mol NaCl中含有6.02×1023个微粒 | |
| D. | H3PO4的摩尔质量是98.0g/mol |