题目内容
14.工业上制取高纯度MnO2的某一步骤如图所示: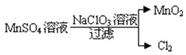
请写出该反应的离子方程式5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+.
分析 由转化图示可知,Mn元素的化合价由+2价升高为+4价,Cl元素的化合价由+5价降低为0,结合电子、电荷守恒配平并写出该反应的离子方程式.
解答 解:由图示可知,Mn元素的化合价由+2价升高为+4价,化合价升高2价;Cl元素的化合价由+5价降低为0,化合价降低5价,化合价变化的最小公倍数10,则锰离子的系数为5,氯酸根离子的系数为2,然后结合质量守恒定律配平可得:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,
故答案为:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+.
点评 本题考查了离子方程式书写、氧化还原反应的配平,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.某同学体检的血液化验单中,葡萄糖为0.0059mol•L?1.表示该体检指标的物理量是( )
| A. | 溶解度(S) | B. | 物质的量浓度(c) | C. | 质量分数(ω) | D. | 摩尔质量(M) |
5.将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH值最接近于( )
| A. | 8.3 | B. | 8 | C. | 9 | D. | 9.7 |
2.下列有关氧化还原反应的叙述正确的是( )
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中应有沉淀、气体或水生成 | |
| C. | 置换反应一定属于氧化还原反应 | |
| D. | 化合反应和复分解反应有可能是氧化还原反应 |
19.在下列给定条件的溶液中,可能大量共存的离子组是( )
| A. | 含有大量Fe3+的溶液中:Na+、SCN-、Cl-、Br- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- | |
| C. | AlO2-、Cl-、Al3+、K+ | |
| D. | 在由水电离出的c(H+)=1.0×10-12mol/L的溶液中:CO32-、Na+、K+、Cl- |
6.亚氨基锂(Li2NH)时一种储氢容量大,安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2=LiNH2+LiH.下列有关说法正确的是( )
| A. | Li+和H+的离子半径相等 | B. | 此法储氢和钢瓶储氢的原理相同 | ||
| C. | 金属锂在空气中燃烧生成Li2O2 | D. | 该反应中H2既是氧化剂又是还原剂 |
6.某溶液中含有Na+、Mg2+、Cl-、SO42-四种离子,已知Na+为0.2mol,Mg2+为0.4mol,Cl-为0.4mol,则SO42-物质的量为( )
| A. | 5mol | B. | 0.3mol | C. | 0.5mol | D. | 0.2mol |