题目内容
5.6月26日是国际禁毒日,据公安部通报,目前冰毒、摇头丸、氯胺酮等新型毒品在我国有较大传播范围,吸、贩新型毒品问题十分突出.已知下列四种毒品的结构简式: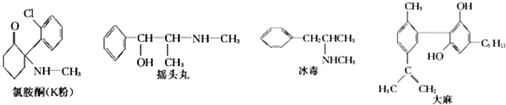
下列说法不正确的是( )
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
分析 A.冰毒含有亚氨基,可与酸反应;
B.摇头丸含有亚氨基和羟基,亚氨基可与酸反应;
C.K粉含有苯环和羰基,可与氢气发生加成反应;
D.大麻中酚-OH的2个邻位与双键与溴水反应.
解答 解:A.冰毒含有亚氨基,可与酸反应,故A正确;
B.摇头丸含有亚氨基和羟基,亚氨基可与酸反应,羟基与碱不反应,不具有酸性,故B错误;
C.K粉含有苯环和羰基,可与氢气发生加成反应,则1molK粉最多可以与4molH2发生加成反应,故C正确;
D.大麻中酚-OH的2个邻位与双键与溴水反应,则1mol大麻与溴水反应最多消耗3mol Br2,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃、醇的性质及迁移应用能力的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
14.化学与生活、生产、环境等社会实际密切相关.下列物质性质与应用对应关系正确的是( )
| A. | 铝合金的大量使用,归功于人们用电解法从氧化铝中获取铝 | |
| B. | 铜的活动性比铁弱,故在海轮外壳装铜块减缓海轮腐蚀 | |
| C. | 用电镀厂的废水中直接灌溉农田,可提高水的利用率 | |
| D. | 甲醛溶液具有杀菌消毒的能力,故能用甲醛溶液浸泡食品 |
20.以下互为同位素的是( )
| A. | 石墨与金刚石 | B. | 1735Cl和1737Cl | C. | CO和CO2 | D. | 1H2、2D2和3T2 |
10.锗(Ge)是第四周期第ⅣA族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是( )
| A. | 锗是一种金属性很强的元素 | B. | 锗的单质具有半导体的性能 | ||
| C. | 锗化氢(GeH4)稳定性很强 | D. | 锗酸(H4GeO4)是难溶于水的弱酸 |
14.下列有关有机物分离提纯或除杂的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2 | |
| B. | 除去乙醇中的微量水可加入金属钠,使其完全反应 | |
| C. | 乙酸乙酯中有乙酸杂质,可以加入氢氧化钠溶液,充分反应后静置分液 | |
| D. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥 |
15.下列四种溶液中,酸性最强的是( )
| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合后所得溶液 |
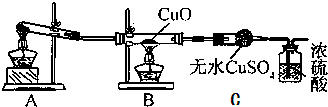
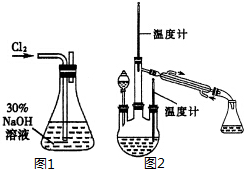 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).