题目内容
16.某化学学习小组同学对实验室制取氨气和氨气的还原性等进行了以下探究,请你参与并完成对有关问题的解答.
[资料获悉]①氨气与CuO反应的化学方程式:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
②Cu2O粉末呈红色;Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+:Cu+$\stackrel{H+}{→}$Cu+Cu2+.
③在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2.
[实验设计]
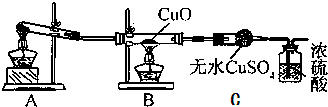
[实验探究]
(1)A装置是氨气的发生装置,则实验前大试管中应加入的药品是NH4Cl、Ca(OH)2.
(2)甲同学认为该实验设计有一定的缺陷,A装置产生的氨气中含有水蒸气,影响了实验结论,应在A和B之间增加一个装有碱石灰(填药品名称)的干燥装置.利用改进后的装置进行实验,可观察到B装置中的现象为黑色固体变成红色,C装置中的现象为无水硫酸铜变蓝.
[交流讨论]
乙同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O(氧化亚铜).现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,用最简便的实验方法证明红色固体中是否含有Cu2O所要选用的试剂是稀硫酸.
丙同学认为可通过高温灼烧红色固体,并称量反应前后固体质量的变化来确定是否含有Cu2O.他先称干燥坩埚的质量为a g,再取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,最后称得总质量为c g.若确认红色固体中只含有Cu,则经高温灼烧后得到的物质是Cu2O.若确认红色固体中含有Cu2O,则a、b、c应符合数学关系为c<$\frac{9b-a}{8}$.
[拓展延伸]
丁同学认为利用上述实验设计改进后的装置还可测定Cu的相对原子质量,他是通过测定反应物CuO的质量和生成物H2O的质量来完成的.若实验测得完全反应的CuO和生成的H2O的质量分别为m(CuO)、m(H2O),则据此计算Cu的相对原子质量的代数式为$\frac{18m(CuO)-16m({H}_{2}O)}{m({H}_{2}O)}$.
分析 [实验探究]
(1)实验室制取氨气根据盐和碱的复分解反应的原理,常用氯化铵固体与熟石灰固体混合加热,生成氯化钙,水和氨气,依此确定大试管中应加入的药品;
(2)氨气是碱性气体,极易溶于水,做氨气干燥剂的物质不能和氨气反应,所以干燥氨气的物质应为碱性或中性;C装置中氨气还原氧化铜生成的产物水使白色硫酸铜变蓝色;
[交流讨论]
依据氧化亚铜在酸溶液中发生自身氧化还原反应,生成铜离子和金属铜,设计实验方法验证红色固体中是否含有Cu2O,不能用强氧化性的酸;依据铜元素守恒结合反应物、生成物质量间的关系分析解答;
[拓展延伸]
根据化学方程式结合氧化铜和水之间的质量情况进行计算.
解答 解:[实验探究]
(1)A装置是氨气的发生装置,实验室制取氨气,通常采用氯化铵和氢氧化钙发生复分解反应,生成氯化钙、氨气和水制得氨气,化学反应方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,所以实验前大试管中应加入的药品是NH4Cl、Ca(OH)2,
故答案为:NH4Cl、Ca(OH)2;
(2)氨气是碱性气体,极易溶于水,做氨气干燥剂的物质不能和氨气反应,碱石灰显碱性,不与氨气反应,可用于干燥氨气,B装置中的现象为黑色固体变成红色,氨气与氧化铜反应生成铜、水、氮气,C装置中水和白色硫酸铜反应生成蓝色五水合硫酸铜,
故答案为:碱石灰;无水硫酸铜变蓝;
[交流讨论]
氧化亚铜在酸溶液中发生自身氧化还原反应,生成铜离子和金属铜,用最简便的实验方法证明红色固体中是否含有Cu2O,实验设计为:取固体样品少许,溶解于稀硫酸溶液中,若溶液呈蓝色,证明红色固体中含有Cu2O,不能用强氧化性的酸浓硝酸、稀硝酸,
故答案为:稀硫酸;
单质铜在空气中加热生成氧化铜,质量增加,氧化铜高温分解生成氧化亚铜和氧气,所以若确认红色固体中只含有Cu,则经高温灼烧后得到的物质是氧化亚铜,氧化亚铜的质量为(c-a)g,铜元素的质量为$\frac{128}{144}$,所取固体质量为(b-a)g,若确认红色固体中含有Cu2O,红色固体为
铜和氧化亚铜的混合物,则铜的质量应小于(b-a)g,即$\frac{128}{144}$<(b-a)g,解得:c<$\frac{9b-a}{8}$,
故答案为:Cu2O;$\frac{9b-a}{8}$;
[拓展延伸]
设铜的相对原子质量为x
2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O
3(x+16)54
m(CuO) m(H2O)
解得:x=$\frac{18m(CuO)-16m({H}_{2}O)}{m({H}_{2}O)}$,
故答案为:$\frac{18m(CuO)-16m({H}_{2}O)}{m({H}_{2}O)}$.
点评 本题考查了实验制备物质的实验过程和反应现象的分析应用,物质检查的方法设计,物质性质和实验基本操作是解题关键,题目难度中等,注意分析题给的条件,注意测定生成水的质量来测铜的相对原子质量.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 明矾作净水剂 | B. | 甘油作护肤保湿剂 | ||
| C. | 铁粉作食品袋内的脱氧剂 | D. | “84消毒液”杀菌消毒 |
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析图示能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
| A. | CO2 | B. | Ca(OH)2 | C. | H2O | D. | CaO |
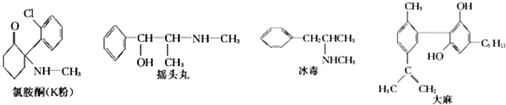
下列说法不正确的是( )
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
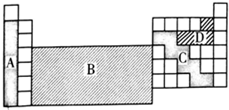
| A. | A | B. | B | C. | C | D. | D |
 .
.