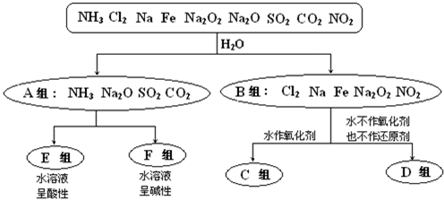
题目内容
15.下列四种溶液中,酸性最强的是( )| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合后所得溶液 |
分析 根据pH=-lgc(H+)以及Kw=c(H+)c(OH-)判断溶液的酸性强弱,c(H+)越大,酸性越强,以此解答.
解答 解:A.pH=14的溶液,c(H+)=1.0×10-13mol•L-1;
B.c(OH-)=1.0×10-13mol•L-1的溶液,c(H+)=1.0×10-1mol•L-1;
C.0.6%的醋酸(ρ=1g•cm-3)醋酸的物质的量浓度为c=$\frac{1000×1×0.6%}{60}$=0.1mol/L,由于醋酸为弱酸,则c(H+)<1.0×10-1mol•L-1;
D.pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合后所得溶液,反应后呈中性,c(H+)=1.0×10-7mol•L-1.
可知酸性最强的为B.
故选B.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确溶液pH的概念及计算方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
5.6月26日是国际禁毒日,据公安部通报,目前冰毒、摇头丸、氯胺酮等新型毒品在我国有较大传播范围,吸、贩新型毒品问题十分突出.已知下列四种毒品的结构简式:
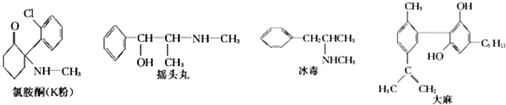
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
6.如图是元素周期表的轮廓图,通常用于制造农药的元素所在的区域是( )
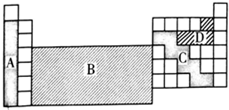

| A. | A | B. | B | C. | C | D. | D |
6.工业生产钠和烧碱的原理如下:①电解熔融氯化钠制钠:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑
②电解饱和食盐水制烧碱:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2 ↑
下列有关说法正确的是 ( )
②电解饱和食盐水制烧碱:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2 ↑
下列有关说法正确的是 ( )
| A. | 在反应①和②中,氯化钠均既是氧化剂,又是还原剂 | |
| B. | 在反应①中氯气是还原产物,在反应②中氢气是还原产物 | |
| C. | 若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等 | |
| D. | 若消耗等质量的氯化钠,则反应①和②中转移电子总数相等 |
3.按要求填写表:
| 分子 | a | 孤对电子数 | δ键数 | VSEPR模型 | 空间构型 |
| CO2 | 4 | 0 | 2 | 直线形 | 直线形 |
| SO2 | 6 | 1 | 2 | 四面体 | V形 |
| NH3 | 5 | 1 | 3 | 四面体 | 三角锥形 |
| CCl4 | 4 | 0 | 4 | 正四面体 | 正四面体 |
4.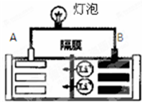 常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )
常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )
 常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )
常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )| A. | 该电池放电时A为负极 | |
| B. | 该电池放电时正极的电极反应式为:Li1-xCoO2+xLi+xe?═LiCoO2 | |
| C. | 该电池充电时阳极质量减轻 | |
| D. | 该电池充电时阴极的电极反应式为:6C+xLi++xe-═LixC6 |