题目内容
3.取a g某物质在氧气完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后过氧化钠固体的质量恰好也增加了ag,下列物质中满足上述结果的是( )| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 蔗糖 |
分析 反应的关系式:H2~H2O~2NaOH~Na2O2•H2,CO~CO2~Na2CO3~Na2O2•CO,有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量,所以只要将有机物能改写为(CO)m.(H2)n的形式就符合条件.
解答 解:反应的关系式:H2~H2O~2NaOH~Na2O2•H2,CO~CO2~Na2CO3~Na2O2•CO,有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量,所以只要将有机物能改写为CO.H2的形式就符合条件,
A.乙烷不能改写为(CO)m.(H2)n形式,所以不符合条件,故A错误;
B.C2H5OH改写为(CO).(H2)3.C形式,所以不符合条件,故B错误;
C.乙酸改写为(CO)2(H2)2,符合条件,故C正确;
D.蔗糖C12H22O11改写为(CO)11(H2)•C,固体质量大于ag,不符合条件,故D错误;
故选C.
点评 本题考查有机物分子式的确定,题目难度中等,明确二氧化碳、水与过氧化钠反应前后固体质量增加量成分是解本题关键,该方法能简化步骤提高解题效率,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.有3份等量的烧碱溶液,第1份直接与盐酸反应;第2份稀释一倍,再与盐酸反应;第3份通入适量的CO2后,再与盐酸反应.若盐酸的浓度相同,完全反应时消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是( )
| A. | V1=V2=V3 | B. | V1>V3>V2 | C. | V2>V3>V1 | D. | V1>V2>V3 |
8.下列有关关系式错误的是( )
| A. | 含1mo1K0H的溶液与1mo1CO2完全反应后,溶液中c(K+)>c(HCO3- ) | |
| B. | 0.2mo1/LCH3COOH溶液与0.1mo1/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 将100mL0.1mo1.L-1的醋酸稀释至pH=4:n(CH3COO-)+n(CH3COOH)=0.01mo1 | |
| D. | pH=5的NaHSO3溶液中:c(HSO3-)+c(SO32-)=c(Na+) |
7.为了测量KI与K2S2O8反应的化学反应速率,某探究性学习小组,在不同条件下将10mol 0.12mol•L-1KI溶液(含少量淀粉)、10mol 0.10mol•L-1Na2S2O3溶液、20mol 0.06mol•L-1K2S2O8溶液混合进行实验,反应的离子方程式如下:2I-+S2O82-═I2+2SO42- I2+2S2O32-═2I-+S4O62-反应速率可以用溶液显蓝色时间t来度量.得到的时间数据如表所示(单位s),下列说法正确的是( )
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
4. 结合如表回答下列问题(均为25℃时的数据)
结合如表回答下列问题(均为25℃时的数据)
(1)上述五种酸中,酸性最强的是HNO2 (填化学式).HCO3-的电离平衡常数表达式K=$\frac{c(C{{O}_{3}}^{2-})•c({H}^{+})}{c(HC{{O}_{3}}^{-})}$.
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+OH-=B(OH)4-,则硼酸为一元酸,硼酸的电离方程式为H3BO3+H2O?B(OH)4-+H+.
(3)常温下,0.01mol•L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是④⑤(填代号).
①c(H+ ) ②$\frac{c(N{O}_{2}^{-})}{c({H}^{+})}$ ③Ka(HNO2)
④$\frac{c({H}^{+})}{c(HN{O}_{2})}$ ⑤c(OH-) ⑥$\frac{c(N{O}_{2}^{-})}{c(HN{O}_{2})•c(O{H}^{-})}$
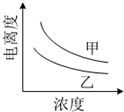
(4)如图描述的是醋酸与HNO2 在水中的电离度与浓度关系,
其中反映醋酸的是曲线乙 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数).
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是d (填代号).
a.H2CO3、HCO${\;}_{3}^{-}$、CH3COO-、CN- b.HCO${\;}_{3}^{-}$、CH3COOH、CN-、CO${\;}_{3}^{2-}$
c.HCN、HCO${\;}_{3}^{-}$、CN-、CO${\;}_{3}^{2-}$ d.HCN、HCO${\;}_{3}^{-}$、CH3COO-、CN
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作).
 结合如表回答下列问题(均为25℃时的数据)
结合如表回答下列问题(均为25℃时的数据)| 酸 | 电力平衡常数(Ka) | 酸 | 电力平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+OH-=B(OH)4-,则硼酸为一元酸,硼酸的电离方程式为H3BO3+H2O?B(OH)4-+H+.
(3)常温下,0.01mol•L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是④⑤(填代号).
①c(H+ ) ②$\frac{c(N{O}_{2}^{-})}{c({H}^{+})}$ ③Ka(HNO2)
④$\frac{c({H}^{+})}{c(HN{O}_{2})}$ ⑤c(OH-) ⑥$\frac{c(N{O}_{2}^{-})}{c(HN{O}_{2})•c(O{H}^{-})}$
(4)如图描述的是醋酸与HNO2 在水中的电离度与浓度关系,
其中反映醋酸的是曲线乙 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数).
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是d (填代号).
a.H2CO3、HCO${\;}_{3}^{-}$、CH3COO-、CN- b.HCO${\;}_{3}^{-}$、CH3COOH、CN-、CO${\;}_{3}^{2-}$
c.HCN、HCO${\;}_{3}^{-}$、CN-、CO${\;}_{3}^{2-}$ d.HCN、HCO${\;}_{3}^{-}$、CH3COO-、CN
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作).