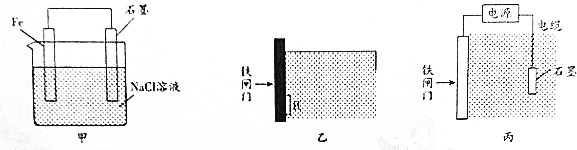
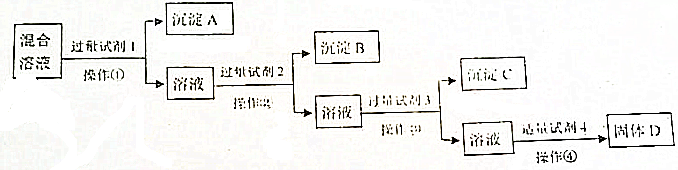
题目内容
6.浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:反应消耗铜的物质的量和质量.分析 根据n=$\frac{V}{{V}_{m}}$计算二氧化硫气体的物质的量,根据方程式Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O计算参加反应Cu的铜的物质的量和质量,由此分析解答.
解答 解:标准化状况下,2.24L二氧化硫的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
令参加反应的Cu的质量为m,则:
Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O
64g 1mol
m 0.1mol
所以m=64g×$\frac{0.1mol}{1mol}$=6.4g,n=$\frac{m}{M}$=$\frac{6.4g}{64g/mol}$=0.1mol,
答:参加反应Cu的铜的物质的量和质量分别为:0.1mol、6.4g.
点评 本题考查根据方程式的有关计算、氧化还原反应等,比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
16.截止2015年1月8日,自2014年入冬以来我省已确诊4例人感染H7N9病毒.预防H7N9病毒最有效的预防方法之一就是用消毒液对禽类养殖、销售、宰杀、加工场所进行消毒.二氧化氯消毒液是国际上公认的新一代强力、安全、高效的消毒剂.它能够迅速、彻底杀灭各种细菌和病毒.二氧化氯消毒液瓶上的标签如表.
(1)1000毫升该二氧化氯消毒液的质量是1200克.
(2)欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水?(写出计算过程)
(1)1000毫升该二氧化氯消毒液的质量是1200克.
(2)欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水?(写出计算过程)
| 二氧化氯消毒液1000mL | |
| 溶质的质量分数 | 80% |
| 密度 | 1.2g/cm3 |
| 强腐蚀性,阴冷,密封储存 | |
14.有3份等量的烧碱溶液,第1份直接与盐酸反应;第2份稀释一倍,再与盐酸反应;第3份通入适量的CO2后,再与盐酸反应.若盐酸的浓度相同,完全反应时消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是( )
| A. | V1=V2=V3 | B. | V1>V3>V2 | C. | V2>V3>V1 | D. | V1>V2>V3 |
7.为了测量KI与K2S2O8反应的化学反应速率,某探究性学习小组,在不同条件下将10mol 0.12mol•L-1KI溶液(含少量淀粉)、10mol 0.10mol•L-1Na2S2O3溶液、20mol 0.06mol•L-1K2S2O8溶液混合进行实验,反应的离子方程式如下:2I-+S2O82-═I2+2SO42- I2+2S2O32-═2I-+S4O62-反应速率可以用溶液显蓝色时间t来度量.得到的时间数据如表所示(单位s),下列说法正确的是( )
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
8.设NA表示阿伏加德罗常数的数值,下列叙述不正确的是( )
| A. | 常温常压下,1mol CO2和CO混合气体含有的碳原子数为NA | |
| B. | 在KIO3+6HI═KI+3I2+3H2O反应中,每生成 3molI2,则转移6NA个电子 | |
| C. | 78gNa2O2与足量的CO2完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol-L-1 Na2S溶液中,阴离子总数大于0.1NA |
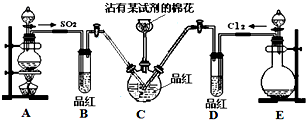 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.