题目内容
8.能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.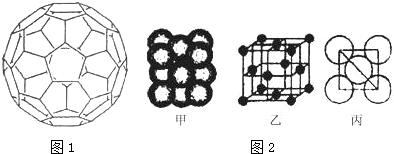
(1)太阳能热水器中常用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式3d84s2它位于周期表d区
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如图1,分子中 碳原子轨道的杂化类型为sp2;1mol C60分子中σ 键的数目为90NA个
(3)Cu单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.晶胞中Cu原子的配位数为12,一个晶胞中Cu原子的数目为4.
(4)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于分子晶体(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是CO.5.
(5)下列说法正确的是BC.
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高.
分析 (1)镍是28号元素,原子核外有28个电子,根据构造原理书写基态镍原子的核外电子排布式的简化形式;
(2)根据价层电子对互斥理论确定杂化方式,利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目;
(3)该类型为面心立方最密堆积;配位数=3×$\frac{1}{2}$×8=12;
(4)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,应为分子晶体;Fe原子有空轨道,CO含有孤对电子,CO为配体,根据化学式Fe(CO)5可知配位数为5;
(5)A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
B.同周期随原子序数增大,元素的电负性增大;
C.离子电荷越大、离子半径越小,晶格能越大,熔沸点越高;
D.二氧化硫为V形结构;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高.
解答 解:(1)镍是28号元素,原子核外有28个电子,根据构造原理基态镍原子的核外电子排布式的简化形式为[Ar]3d84s2,所以外围电子排布式3d84s2,位于d区,故答案为:3d84s2;d区;
(2)每个碳原子含有的σ键个数且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为$\frac{3}{2}$,所以1mol C60分子中σ键的数目=$\frac{3}{2}$×60NA=90NA,故答案为:sp2,90NA;
(3)根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×$\frac{1}{2}$×8=12,由图2可知占据顶点和面心,则个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:12;4;
(4)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,应为分子晶体;Fe原子有空轨道,CO含有孤对电子,故CO为配体,根据化学式Fe(CO)5可知配位数为5,故答案为:分子晶体;CO;5;
(5)A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>S>Si,故A错误;
B.同周期随原子序数增大,元素的电负性增大,故电负性C<N<O<F,故B正确;
C.离子电荷越大、离子半径越小,晶格能越大,熔沸点越高,晶格能CaO比KCl高,所以KCl比CaO熔点低,故C正确;
D.二氧化硫与二氧化碳均为酸性氧化物,化学性质相似,二氧化碳分子为直线型结构,但二氧化硫为V形结构,故D错误;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高,故E错误,
故选:BC.
点评 本题主要考查了原子核外电子排布、分子结构及晶体结构和晶胞的计算等知识,都是基础知识的运用,解题时要注意对晶体结构的分析和判断.中等难度.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)<c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1 mol/L 的Na2S溶液中,c(OH)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
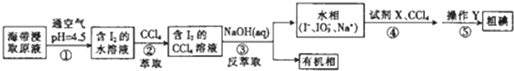
| A. | 步骤②中的萃取过程为物理变化 | |
| B. | 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 | |
| C. | 步骤④所加的试剂X可能是稀硫酸 | |
| D. | 步骤⑤涉及的主要操作Y为分液和蒸馏 |
 .关于它的说法正确的是( )
.关于它的说法正确的是( )| A. | 利尿酸的化学式为:C13H14O4Cl2 | |
| B. | 利尿酸最多可与4 molH2发生反应 | |
| C. | 利尿酸可使溴的四氯化碳溶液褪色 | |
| D. | 利尿酸在一定条件下能发生消去反应 |
| A. | 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低 | |
| B. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| C. | 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
①金属性最强的是铯
②它们的氧化物都只有M2O和M2O2两种形式
③在自然界中均以化合态形式存在
④密度按Li→Cs 顺序依次递增
⑤离子半径:Rb+>K+>Na+.
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ①③⑤ |
| A. | 1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量 |
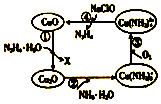 水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.
水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.