题目内容
6.某种镧镍合金(LaNi5)具有吸收释放氢的特性,是目前应用最广泛的贮氢合金之一.回答下列问题:(1)灼烧草酸镧[La2(C2O4)3]可获得La2O3,La2O3是制备镧镍合金的重要原料,该灼烧过程的化学方程式为La2(C2O4)3$\frac{\underline{\;加热\;}}{\;}$La2O3+3CO↑+3CO2↑.
(2)氯化镧晶体(LaCl3•7H2O)溶于水与草酸反应可制备草酸镧:
①无水氯化镧具有强烈的吸湿性,在空气中加热易生成氯氧化物,加热过程的化学方程式为LaCl3+H2O$\frac{\underline{\;加热\;}}{\;}$LaOCl+2HCl↑.
②由氯化镧水溶液受热浓缩制备氯化镧晶体时,需要在氯化氢氛围中进行,原因是氯化氢氛围能抑制氯化镧水解.
(3)制备LaNi5的工艺流程为:用HNO3溶解La2O3后,与Ni(NO3)2溶液混合,加入一定量的甘氨酸络合,高温灼烧得到混合氧化物(LaxNiyOz)后,与过量的CaH2混合并研磨,并加入一定量的NaCl,在H2氛围中灼烧、冷却.将所得产物酸洗、水洗至中性,再用无水乙醇洗涤,得到LaNi5合金.
①氢气在上述制备过程中的作用是做保护气,防止产品被氧化,用无水乙醇洗涤LaNi5合金的目的是利用乙醇容易挥发的特性加快LaNi5合金的干燥.
②得到的氧化物中La与Ni原子个数比为1:5,LaxNiyOz可表示为aLa2O3•bNiO的形式,则a:b=1:10.
③上述氧化物与过量的CaH2混合研磨,可获得LaNi5和另一种化合物,该过程的化学方程式为2La2O3+20NiO+13CaH2=4LaNi5+13Ca(OH)2.
分析 根据灼烧草酸镧[La2(C2O4)3]得产物La2O3,分析La2O3中的镧的价态未变,则碳的价态升高为CO2,降低为CO,再依据氧化还原反应方程式配平方法配平,即得方程式.
(1)La2(C2O4)3$\frac{\underline{\;加热\;}}{\;}$La2O3+3CO↑+3CO2↑;
(2)无水氯化镧具有强烈的吸湿性,在空气中加热易发生水解,HCL产物具有挥发性,使氯化镧强烈水解,得方程式:①LaCl3+H2O$\frac{\underline{\;加热\;}}{\;}$LaOCl+2HCl↑;
②由氯化镧水溶液受热浓缩制备氯化镧晶体时,需在氯化氢氛围中进行,为抑制氯化镧强烈水解;
(3)①LaNi5合金易被空气氧化,故需在H2氛围中灼烧、冷却.乙醇易挥发,故用乙醇洗涤,加快干燥LaNi5的速度;
②得到的氧化物中La与Ni原子个数比为1:5,LaxNiyOz可表示为aLa2O3•bNiO的形式,根据元素守恒,可得a:b=1:10;
③根据氧化还原反应的原理分析,镧元素价态降低,氢元素价态升高,上述氧化物与过量的CaH2混合研磨,可获得LaNi5和另一种化合物Ca(OH)2,该过程的化学方程式为:2La2O3+20NiO+13CaH2=4LaNi5+13Ca(OH)2.
解答 解:(1)依据氧化还原反应原理得化学方程式:La2(C2O4)3$\frac{\underline{\;加热\;}}{\;}$La2O3+3CO↑+3CO2↑,故答案为:La2(C2O4)3$\frac{\underline{\;加热\;}}{\;}$La2O3+3CO↑+3CO2↑;
(2)①氯化镧强烈水解,得方程式:LaCl3+H2O$\frac{\underline{\;加热\;}}{\;}$LaOCl+2HCl↑,故答案为:LaCl3+H2O$\frac{\underline{\;加热\;}}{\;}$LaOCl+2HCl↑;
②为抑制氯化镧强烈水解,故氯化镧在氯化氢氛围中进行,故答案为:氯化氢氛围能抑制氯化镧水解;
(3)①LaNi5合金易被空气氧化,用H2作保护气,防止产品被氧化,用无水乙醇洗涤LaNi5合金,加快LaNi5合金的干燥,故答案为:作保护气,防止产品被氧化,利用乙醇容易挥发的特性加快LaNi5合金的干燥;
②根据元素守恒,可得a:b=1:10,故答案为:1:10;
③依据氧化还原反应原理得化学方程式:2La2O3+20NiO+13CaH2=4LaNi5+13Ca(OH)2,故答案为:2La2O3+20NiO+13CaH2=4LaNi5+13Ca(OH)2.
点评 本题考查物质制备工艺流程,涉及对操作的分析评价、对信息获取与应用等,侧重对化学用语的考查,熟练掌握元素化合物知识,题目难度中等

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| 选项 | 实验操作和现象 | 结论 |
| A | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| B | 向均盛有2mL5% H2O2 溶液的两支试管中分别滴入0.2mol•L-1 FeCl3,和0.3mol.L-1CuCl2 溶lmL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象. | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 盐酸 | B. | 雾 | C. | 氯化钠溶液 | D. | CuSO4溶液 |
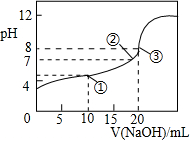 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)<c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1 mol/L 的Na2S溶液中,c(OH)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
| A. | 25℃时1mL水中含10-10 NA个OH-离子 | |
| B. | 1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA | |
| C. | a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L | |
| D. | 0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA |
 .关于它的说法正确的是( )
.关于它的说法正确的是( )| A. | 利尿酸的化学式为:C13H14O4Cl2 | |
| B. | 利尿酸最多可与4 molH2发生反应 | |
| C. | 利尿酸可使溴的四氯化碳溶液褪色 | |
| D. | 利尿酸在一定条件下能发生消去反应 |
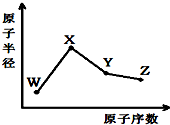 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.