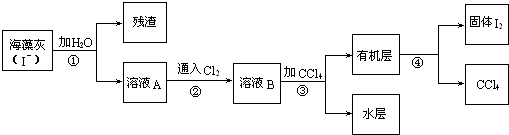
题目内容
8.一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)═PCl3(g)+Cl2(g)| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
分析 A.I、Ⅱ温度相同,则二者平衡常数相等,Ⅲ比I相比温度升高,平衡时Ⅲ中PCl3比I中的大,说明升高温度平衡正向移动,平衡常数增大;
B.恒温恒容下,Ⅱ等效在I中平衡基础上压强增大一倍,平衡逆向移动,转化率减小;
C.速率之比等于化学计量数之比,则v(PCl5)=v(PCl3)=$\frac{△c(PC{l}_{3})}{△t}$;
D.410℃平衡时PCl5为0.4mol-0.15mol=0.25mol,根据K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$计算平衡常数,再计算浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:A.I、Ⅱ温度相同,则二者平衡常数相等,Ⅲ比I相比温度升高,平衡时Ⅲ中PCl3比I中的大,说明升高温度平衡正向移动,平衡常数增大,故平衡常数K:容器Ⅱ<容器Ⅲ,故A错误;
B.恒温恒容下,Ⅱ等效在I中平衡基础上压强增大一倍,平衡逆向移动,转化率减小,PCl5的转化率:容器Ⅱ<容器Ⅰ,故B错误;
C.速率之比等于化学计量数之比,则v(PCl5)=v(PCl3)=$\frac{△c(PC{l}_{3})}{△t}$=$\frac{\frac{0.1mol}{2L}}{{t}_{1}s}$=$\frac{0.05}{{t}_{1}}$mol/(L•s),故C错误;
D.410℃平衡时PCl5为0.4mol-0.15mol=0.25mol,该温度下平衡常数K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{\frac{0.15}{2}×\frac{0.15}{2}}{\frac{0.25}{2}}$=0.045,浓度商Qc=$\frac{\frac{0.45}{2}×\frac{0.1}{2}}{\frac{0.3}{2}}$=0.075>K=0.045,反应向逆反应进行,故D正确,
故选:D.
点评 本题考查化学平衡计算与影响因素、化学反应速率、平衡常数及其应用等,A、B选项注意利用等效平衡分析解答,掌握平衡常数应用,难度中等.

| A. | 该晶体中一定含有SCN- | B. | Fe3+的氧化性比I2的氧化性强 | ||
| C. | Fe3+被I-还原 | D. | Fe2+是氧化产物 |
| A. | H2O2 | B. | MgCl2 | C. | NaOH  | D. | CCl4 |
| A. | 恒容通入一定量的SO2 | B. | 增大体系容积 | ||
| C. | 恒容移去部分SO3 | D. | 降低体系温度 |
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准液滴定待测液,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 中和热测定实验中,将碱缓慢倒入酸中,所测温度值偏小 |