题目内容
3.世界能源消费的90%以上依靠化学技术.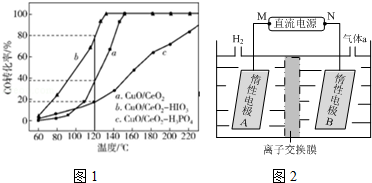
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:2C(s)+O2(g)═2CO(g)△H1=-220.70kJ•mol-1
2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ•mol-1
H2O(l)═H2O(g)△H3=+44.0kJ•mol-1
则C(s)+H2O(g)═CO(g)+H2(g)△H4=+131.45kJ/mol
(2)燃料气(流速为3000mL•h-1;体积分数为50% H2,0.90% CO,1.64% O2,47.46% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.CeO2可由草酸铈[Ce2(C2O4)3]灼烧制得,反应的化学方程式为Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑;在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1示.
加入HIO3(填酸的化学式)的$\frac{CuO}{Ce{O}_{2}}$催化剂催化性能最好.催化剂为$\frac{CuO}{Ce{O}_{2}}$-HIO3,120℃时,反应1h后CO的体积为5.4mL.
(3)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备的装置如图2已知产生的气体a通入淀粉KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去.则M极为电源的负(填“正”或“负”)极,B极区电解液为LiCl溶液(填化学式),该离子交换膜是阳(填“阳”或“阴”)离子交换膜.
分析 (1)已知:①.2C(s)+O2(g)═2CO(g)△H1=-220.70kJ•mol-1
②.2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ•mol-1
③.H2O(l)═H2O(g)△H3=+44.0kJ•mol-1
根据盖斯定律,①×$\frac{1}{2}$+②×$\frac{1}{2}$-③可得:反应C(s)+H2O(g)═CO(g)+H2(g),所以△H4=△H1×$\frac{1}{2}$+△H2×$\frac{1}{2}$-△H3;
(2)灼烧草酸铈[Ce2(C2O4)3]分解制得CeO2、一氧化碳以及二氧化碳;
相同时间内,CO的转化率越高,说明催化性能越好;
催化剂为$\frac{CuO}{Ce{O}_{2}}$-HIO3,120℃时,CO优先氧化为二氧化碳,反应方程式为:2CO+O2$\frac{\underline{\;CuO/CeO_{2}\;}}{120℃}$2CO2,CO气体混合物流速为3000mL•h-1,体积分数为:0.90%的CO,再结合CO的转化率是80%计算;
(3)产生的气体a通入淀粉KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去,则气体a为Cl2,左侧生成氢气,则A中氢离子放电,可知A为阴极,在A中制备LiOH,Li+由A经过阳离子交换膜向B移动,B中为LiCl溶液,氯离子放电生成氯气.
解答 解:(1)已知:①.2C(s)+O2(g)═2CO(g)△H1=-220.70kJ•mol-1
②.2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ•mol-1
③.H2O(l)═H2O(g)△H3=+44.0kJ•mol-1
根据盖斯定律,①×$\frac{1}{2}$+②×$\frac{1}{2}$-③可得:反应C(s)+H2O(g)═CO(g)+H2(g),所以△H4=△H1×$\frac{1}{2}$+△H2×$\frac{1}{2}$-△H3=$\frac{1}{2}$×(-220.7kJ•mol-1)+(571.6kJ•mol-1)×$\frac{1}{2}$-44.0kJ•mol-1=+131.45kJ/mol,
故答案为:+131.45kJ/mol,
(2)灼烧草酸铈[Ce2(C2O4)3]分解制得CeO2、一氧化碳以及二氧化碳,反应方程式为:Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑;
相同时间内,CO的转化率越高,说明催化性能越好,由图象知道当HIO3加入时,催化性能最好;
催化剂为$\frac{CuO}{Ce{O}_{2}}$-HIO3,120℃时,CO优先氧化为二氧化碳,反应方程式为:2CO+O2$\frac{\underline{\;CuO/CeO_{2}\;}}{120℃}$2CO2,CO气体混合物流速为3000mL•h-1,体积分数为:0.90%的CO,则反应1小时后CO的体积为3000mL•h-1×1h×0.90%×(1-80%)=5.4mL,
故答案为:Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑;HIO3;5.4;
(3)产生的气体a通入淀粉KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去,则气体a为Cl2,左侧生成氢气,则A中氢离子放电,可知A为阴极,M是负极,在A中制备LiOH,Li+由A经过阳离子交换膜向B移动,离子交换膜是阳离子交换膜,B中为LiCl溶液,氯离子放电生成氯气,
故答案为:负;LiCl;阳.
点评 本题考查反应热有关计算、电解原理应用、读图获取信息能力等,侧重于考查学生分析解决问题与知识迁移运用,题目难度中等.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | Fe2+、Al3+、SO42-、H+ | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | Mg2+、H+、SO42-、HCO3- | D. | Fe3+、Na+、SCN-、Cl- |
| A. | 90和18 | B. | 88和20 | C. | 90和20 | D. | 88和18 |
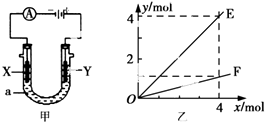
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
| A. | AgCl的沉淀生成和溶解不断进行,但速率不相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 升高温度,AgCl的溶解度增大 | |
| D. | 向平衡体系中加入NaCl固体,AgCl的溶解度变小 |
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是还原产物 | |
| C. | H2C2O4在反应中被还原 | |
| D. | 1mol H2C2O4参加反应有2mol电子转移 |