题目内容
酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl + H2O = H3O+ + Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4) = 6.3 × 10-9 ,Ka(HNO3) = 4.2 × 10-10。 下列说法正确的是
A.冰醋酸中H2SO4的电离方程式:H2SO4 + 2CH3COOH = SO42-+ 2CH3COOH2+
B.H2SO4的冰醋酸溶液中:c(CH3COOH2+) = c(HSO4-)+ 2c(SO42-) + c(CH3COO-)
C.浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)> pH(HNO3)
pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸,c(CH3COOH2+)/c(HNO3)减小
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.向含Na+、Al3+、Fe3+、Fe2+、Cl-、SO42-的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,所得溶液与起始溶液相比,上述离子数目没有变化的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
2.下列图示与对应的叙述不相符的是( )


| A. | 图1表示KNO3的溶解度曲线,图中a点所示溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示反应aA(g)+bB(g)?cC(g)表示改变某一条件对化学平衡的影响,若p1>p2 此反应自发进行,必须满足的条件是低温 | |
| D. | 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
4.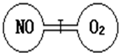 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )
 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )| A. | 开始时左右两室分子数相同 | B. | 反应开始后NO室压强减小 | ||
| C. | 最终容器内密度与原来相同 | D. | 最终容器内仍然有O2存在 |


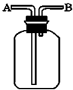 现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.
现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.