题目内容
2.下列图示与对应的叙述不相符的是( )
| A. | 图1表示KNO3的溶解度曲线,图中a点所示溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示反应aA(g)+bB(g)?cC(g)表示改变某一条件对化学平衡的影响,若p1>p2 此反应自发进行,必须满足的条件是低温 | |
| D. | 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
分析 A、溶解度曲线上的点是饱和溶液,曲线以下的点是不饱和溶液来分析;
B、放热反应,反应物的总能量大于生成物的总能量,反应中加入催化剂会降低活化能,改变反应的速率,但反应热不改变;
C、利用图象分析出△H和△S大小,再据△H-T△S大小分析;
D、先弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,假设有1molNH4Al(SO4)2反应,当1molAl3+沉淀完全时需加入3molOH-,即加入1.5molBa(OH)2,加入的Ba2+为1.5mol,SO42-未完全沉淀,此时溶液含有硫酸铵;(开始到a)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入2molBa(OH)2,加入4molOH-,Al3+反应掉需3molOH-,生成Al(OH)31mol,剩余1molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使1molAl(OH)3完全溶解,需再加入0.5molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液,(b到c),据此分析.
解答 解:A、溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,故A正确;
B、催化剂能降低反应的活化能,但不能影响平衡移动,不能影响反应物生成物的能量高低,故B正确;
C、从图象可见,随压强增大A的转化率增大,说明加压时平衡正向移动,则a+b>c,△S<0,随温度升高A的转化率降低,说明升温时平衡逆向移动,则△H<0,当△H-T△S<0时,反应自发进行,低温时,△H-T△S<0,反应都能自发进行,故C不正确;
D、向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液时,关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当1molAl3+沉淀完全时需加入3molOH-,即加入1.5molBa(OH)2,加入的Ba2+为1.5mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入2molBa(OH)2,加入4molOH-,Al3+反应掉3molOH-,生成Al(OH)31mol,剩余1molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使1molAl(OH)3完全溶解,需再加入0.5molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液,(b到c),故D正确.
故选:C
点评 本题结合图象分析问题,难度增大,特别是D选项,应逐一分析.

| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
 pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 气体,增大A的量,A、B的转化率都增大
气体,增大A的量,A、B的转化率都增大 pH(HNO3)
pH(HNO3) (NH3·H2O)+c(NH3)=0.1mol·L-1
(NH3·H2O)+c(NH3)=0.1mol·L-1 原氨水中:c(NH4+)+c(H+)=c(OH-)
原氨水中:c(NH4+)+c(H+)=c(OH-) 2SO3(g);3Fe
2SO3(g);3Fe (s)+4H2O(g)
(s)+4H2O(g)
 数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。
数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。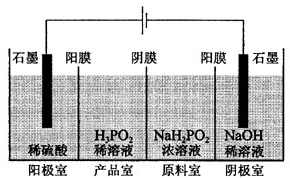 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: