题目内容
下列各项表达正确的是( )
| A、NaH是离子化合物,则NaH的电子式为Na:H |
| B、碘-131是一种放射性元素,其简单阴离子的核外电子数为53 |
| C、等物质的量的HCl和NaCl中分子数相等 |
| D、核素A与核素B的质量数相等,中子数不相等,它们一定不是同位素 |
考点:电子式,物质的量的相关计算,质量数与质子数、中子数之间的相互关系
专题:
分析:A、NaH是离子化合物,由Na+和H-离子组成;
B、简单阴离子为得到电子后的电子数;
C、氯化钠为离子晶体,不存在分子;
D、核素A与核素B的质量数相等,中子数不相等,那么他们的质子数一定不相同.
B、简单阴离子为得到电子后的电子数;
C、氯化钠为离子晶体,不存在分子;
D、核素A与核素B的质量数相等,中子数不相等,那么他们的质子数一定不相同.
解答:
解:A、NaH是离子化合物,由Na+和H-离子组成,电子式为Na+[:H]-,故A错误;
B、碘的原子序数为53,碘原子核外电子数为53,得到1个电子后形成简单阴离子,故阴离子的核外电子数是54,故B错误;
C、氯化钠不是分子晶体,不存在分子,故C错误;
D、核素A与核素B的质量数相等,中子数不相等,那么他们的质子数一定不相同,故D正确,故选D.
B、碘的原子序数为53,碘原子核外电子数为53,得到1个电子后形成简单阴离子,故阴离子的核外电子数是54,故B错误;
C、氯化钠不是分子晶体,不存在分子,故C错误;
D、核素A与核素B的质量数相等,中子数不相等,那么他们的质子数一定不相同,故D正确,故选D.
点评:本题主要考查的是核素的概念、离子晶体的概念等,属于基础题.

练习册系列答案
相关题目
 在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )| A、平衡时N的转化率为50% |
| B、当温度升高后,则图中θ>450 |
| C、若再加入N,则正、逆反应速率均逐渐增大 |
| D、若在加入N,则反应体系中气体密度减小 |
下列叙述正确的是( )
| A、足量的硫单质与64g铜反应,有2mol电子发生转移 |
| B、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Kap(AgCl)增大 |
| C、0.1mol?L-1Na2CO3中加入少量NaOH固体振荡,c(Na+)和c(CO32-)都增大 |
| D、相同浓度的CH2COOH和CH2COONa溶液等体积混合后,则:c(CH2COO-)+c(CH2COOH)=c(Na+) |
下列反应的离子方程式书写错误的是( )
| A、向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、1 L 2 mol?L-1的FeBr2溶液中通入2.5 mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 |
| D、在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
下列叙述正确的是( )
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
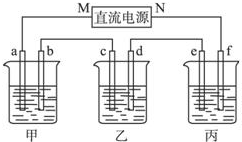 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: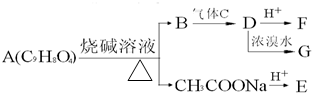 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题: