题目内容
16.下列实验现象,与新制氯水中的某些成分(括号内物质)没有直接关系的是( )| A. | 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2) | |
| B. | 新制氯水使红色布条褪色(Cl2) | |
| C. | 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) | |
| D. | 向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+) |
分析 氯气与水反应,发生Cl2+H2O?H++Cl-+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,以此解答,
A.溶液呈红色是因为氯水中的氯气氧化氯化亚铁为氯化铁,铁离子遇到KSCN溶液,溶液呈红色;
B.新制氯水使红色布条褪色是氯水中的次氯酸具有氧化性、漂白性,能氧化使有机色素变为无色;
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生是氯水中的氯离子结合银离子生成氯化银沉淀;
D.有无色气泡产生是氯水中的盐酸和碳酸氢钠反应生成二氧化碳气体.
解答 解:A.向FeCl2溶液中滴加新制氯水是氯气氧化了亚铁离子,Cl2+2Fe2+=2Fe3++2Cl-,故A不选;
B.新制氯水使红色布条褪色,是氯水中的次氯酸具有强氧化性,能氧化有色布条褪色,氯气不具有漂白性,故B选;
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生,是氯水中氯离子和硝酸银溶液中银离子反应生成氯化银白色沉淀,Ag++Cl-=AgCl↓,故C不选;
D.氯水显酸性,氯水中的盐酸能与碳酸氢钠反应生成CO2气体,H++HCO3-=H2O+CO2↑,故D不选;
故选B.
点评 本题考查氯气的性质,侧重于氯水的组成和性质的考查,为高频考点,难度大不,注意把握相关物质的性质.

练习册系列答案
相关题目
6.在酸性溶液中能大量共存的离子组是( )
| A. | OH-、HCO3-、Na+ | B. | Cu2+、NH4+、OH- | C. | Ba2+、K+、NO3- | D. | Ag+、Cl-、SO42- |
7.2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)在该可逆反应中,当化学平衡逆向移动时,体系气体的平均分子量会( )
| A. | 不确定 | B. | 变小 | C. | 不变 | D. | 变大 |
4.某固体化合物M不导电,溶于水能完全电离.下列关于物质M的说法正确的是( )
| A. | M一定是强电解质 | B. | M一定是弱电解质 | C. | M一定是某种盐 | D. | M一定是某种强碱 |
11.下列关于物质应用的说法中错误的是( )
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
1.做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸,化学式为H2C2O4)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+H2C2O4+H+═CO2↑+Mn2++□(未配平).下列叙述不正确的是( )
| A. | 发生氧化反应的是H2C2O4 | |
| B. | 离子方程式右侧方框内的产物是H2O | |
| C. | 每消耗6 mol H+,转移5 mol电子 | |
| D. | 还原性:Mn2+<H2C2O4 |
8.x克的NaOH必须溶解在45克水中,才能使每20个水分子中溶有1个Na+,此时溶液的质量分数是y,则x、y的值为( )
| A. | x=2.25 y=4.74% | B. | x=5 y=11.11% | ||
| C. | x=5 y=10% | D. | x=2.875 y=5.75% |
6.下列各组物质中所含分子数相同的是( )
| A. | 10g CO和10g N2 | B. | 10g C2H4和10g C3H6 | ||
| C. | 5.6L O2(标准状况)和0.5mol H2O | D. | 224mL He(标准状况)和1.6g CH4 |
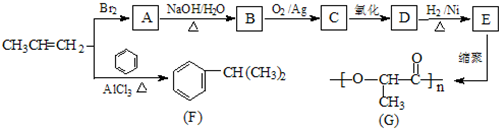
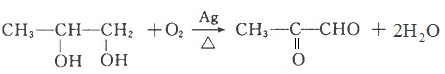 .
.