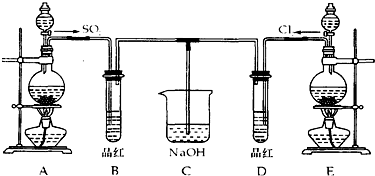
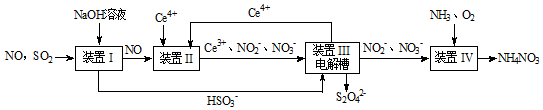
题目内容
4.下列叙述正确的是( )| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| C. | 向饱和硼酸溶液中滴加Na2CO3溶液,有CO2气体生成 | |
| D. | 原电池中发生的反应达平衡时,该电池仍有电流产生 |
分析 A.1mol氢气燃烧生成液态水时的热量为燃烧热;
B.△H-T△S<0的反应可自发进行;
C.非金属性C>B,则碳酸的酸性大于硼酸;
D.原电池中发生的反应达平衡时,各组分浓度不再改变,两个电极上电势相等.
解答 解:A.1mol氢气燃烧生成液态水时的热量为燃烧热,若生成气态水,热量小于燃烧热中热量,故A错误;
B.△H-T△S<0的反应可自发进行,则某吸热反应能自发进行,因此该反应是熵增反应,故B正确;
C.非金属性C>B,则碳酸的酸性大于硼酸,则向饱和硼酸溶液中滴加Na2CO3溶液,一定不生成二氧化碳,故C错误;
D.原电池中发生的反应达平衡时,各组分浓度不再改变,每个电极上得失电子相同,两个电极上电势相等,则该电池没有电流产生,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应进行方向的判断、燃烧热判断、物质的性质及反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度中等.

练习册系列答案
相关题目
14.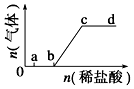 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| C. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
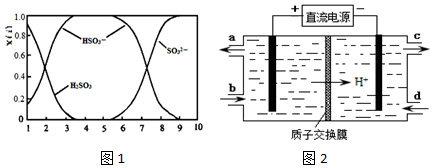
15. 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A. | 该反应的还原剂是Cl- | |
| B. | 反应后溶液的酸性明显增强 | |
| C. | 消耗1mol还原剂,转移6 mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为2:3 |
12.某些化学知识用数轴表示能体现出形象直观、简明易记的特点.下列用数轴表示不合理 的是( )
| A. | 平衡常数与转化关系: | |
| B. | 向烧碱液中通入SO2后的产物: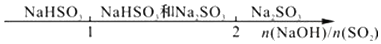 | |
| C. | 铁和稀硝酸反应: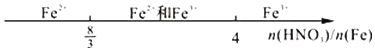 | |
| D. | 向AlCl3 溶液中滴加 NaOH 溶液,铝元素的存在形式: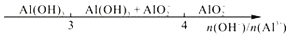 |
19.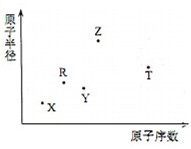 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )| A. | 形成的简单离子半径的大小顺序为T>Y>Z | |
| B. | Z2Y、Z2Y2所含有的化学键类型相同 | |
| C. | 0.005mol•L-1T的最高价氧化物对应水化物的水溶液pH等于2 | |
| D. | Z2T的水溶液显碱性,对水的电离有促进作用 |