题目内容
15. 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A. | 该反应的还原剂是Cl- | |
| B. | 反应后溶液的酸性明显增强 | |
| C. | 消耗1mol还原剂,转移6 mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为2:3 |
分析 由曲线变化图可知,随反应进行ClO-的物质的量减少,则ClO-为反应物,由N元素变化可知,NH4+应是反应物,N2是生成物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:A.由以上分析可知NH4+为还原剂,故A错误;
B.反应方程式为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,可知反应后溶液的酸性明显增强,故B正确;
C.还原剂为NH4+,N元素化合价由-3价升高到0价,则消耗1mol还原剂,转移3mol电子,故C错误;
D.由方程式可知氧化剂和还原剂的物质的量之比为3:2,故D错误.
故选B.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
5.环蕃是一种光电信息材料.环蕃的合成路线如图:
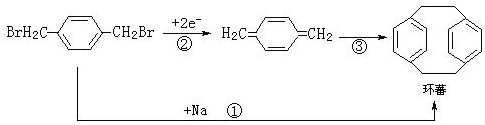
下列说法正确的是( )

下列说法正确的是( )
| A. | 反应①属于水解反应 | |
| B. | 反应③属于加成反应 | |
| C. | 环蕃所有的碳原子一定在同一个平面上 | |
| D. | 环蕃的核磁共振氢谱有3组峰 |
6.室温下某溶液中由水电离出的H+浓度为1.0×10-13mol•L-1,则在此溶液中一定不可能大量存在的离子组是( )
| A. | Al3+、K+、NO3-、Cl- | B. | K+、Na+、HCO3-、Cl- | ||
| C. | Na+、CO32-、SO42-、NO3- | D. | Ba2+、Na+、Cl-、NO3- |
3.有机物R的分子式为C5H12O,能与乙酸发生酯化反应,则R的结构有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
20.下列说法正确的是( )
| A. | 海水淡化的常用方法有蒸馏法、离子交换法和电解法 | |
| B. | 钢铁在焊接前可以用NH4C1溶液的酸性清除表面的铁锈 | |
| C. | 甲醛和苯酚通过加聚反应制得酚醛树脂 | |
| D. | 在轮船外壳上焊接锌块或接直流电源正极,均可减缓船体的腐蚀速率 |
7. 通过膜电池可除去废水中的乙酸钠和对氯笨酚(
通过膜电池可除去废水中的乙酸钠和对氯笨酚( ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
 通过膜电池可除去废水中的乙酸钠和对氯笨酚(
通过膜电池可除去废水中的乙酸钠和对氯笨酚( ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | B为电池的正极,发生还原反应 | |
| B. | 电流方向从B极沿导线经小灯泡流向A极 | |
| C. | A极的电极反应式为 +e-═Cl-+ +e-═Cl-+ | |
| D. | 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA |
4.下列叙述正确的是( )
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| C. | 向饱和硼酸溶液中滴加Na2CO3溶液,有CO2气体生成 | |
| D. | 原电池中发生的反应达平衡时,该电池仍有电流产生 |
18. 某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )
 某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )| A. | 反应2min末X的浓度为0.35mol/L | |
| B. | 该反应的化学方程式可表示为:2Z?2Y+3X | |
| C. | 反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(L•min) | |
| D. | 任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y) |

 .
.