题目内容
13.下列有关说法正确的是( )| A. | 工业上通常用电解钠、铁、铜对应的氯化物来制备这三种金属的单质 | |
| B. | 陶瓷、玻璃、水泥属于传统无机硅酸盐材料 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了“丹砂”,该过程无氧化还原反应发生 | |
| D. | “青篙一握,以水二升渍,绞取汁”屠呦呦对青蒿素的提取属于化学变化 |
分析 A.用热还原法冶炼Fe和铜;
B.根据陶瓷,普通玻璃,水泥的成分分析;
C.HgS受热分解为Hg和S;
D.对青蒿素的提取利用了萃取.
解答 解:A.Fe和铜的活泼性较弱,用热还原法冶炼Fe和铜,Na活泼性很强用电解熔融的氯化钠制备,故A错误;
B.陶瓷,普通玻璃,水泥的成分均为硅酸盐,所以陶瓷,普通玻璃,水泥属于硅酸盐材料,故B正确;
C.HgS受热分解为Hg和S,反应中Hg、S元素的化合价发生变化,属于氧化还原反应,故C错误;
D.对青蒿素的提取利用了萃取,萃取过程中没有新物质生成,属于物理变化,故D错误.
故选B.
点评 本题考查了物质的性质及用途、金属的冶炼方法,根据金属的活泼性强弱确定冶炼方法、根据物质的性质分析其用途,题目难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
4.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
| A. | lmolKClO3参加反应生成气体的体积为22.4L(标况下) | |
| B. | 该反应的还原产物为CO2 | |
| C. | 0.5mol H2C2O4参加反应有lmol电子转移 | |
| D. | H2SO4在反应中是氧化剂 |
8.用NA表示阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 1.0L 1.0mol•L-1Na2SO4水溶液中含有的氧原子数为4NA | |
| C. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数为0.1NA | |
| D. | 常温下,2L0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液所含Fe3+数目不同 |
18.已知①中国古代四大发明之一的黑火药,它是由硫磺、木炭粉和硝石组成;②油条中铝含量超标十分普遍,是影响人们健康的食品安全隐患.油条无铝配方由碳酸氢钠(小苏打)和臭粉组成.下列关于硝石和臭粉的成份组合正确的是( )
| A. | KNO3、NH4HCO3 | B. | KNO3、Na2CO3 | C. | HNO3、(NH4)2CO3 | D. | NH4NO3、Na2CO3 |
5.下列说法正确的是( )
| A. | 石蜡油经分馏可以获得乙烯 | |
| B. | 乙二酸、苯酚、苯乙烯均可发生聚合反应 | |
| C. | 室温下,在水中的溶解度:丙烷>乙醇>乙二醇 | |
| D. | 可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 |
2.X、Y、Z、W四种短周期主族元素,其中W是非金属性最强的元素,它们在周期表中位置如表所示,下列说法不正确的是( )
| X | Y | W | |
| Z |
| A. | 四种元素的单质中,W的氧化性最强 | |
| B. | Z元素的气态氢化物稳定性比W强 | |
| C. | Y元素的氧化物对应水化物的酸性一定比Z弱 | |
| D. | X、Z元素能形成化学式为XZ2的化合物 |
12.12mol/L的盐酸50ml与足量的MnO2在加热条件下反应,可以制得的Cl2的物质的量为( )
| A. | 0.3mol | B. | 小于0.15mol | C. | 0.15~0.3mol | D. | 0.15mol |
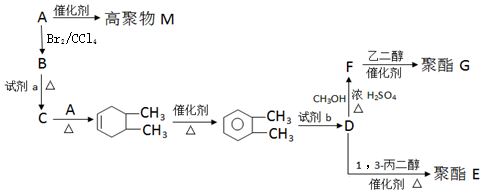
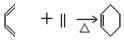
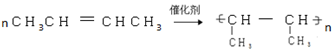 ②B→C
②B→C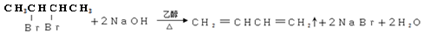
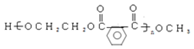 .
. 以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)