题目内容
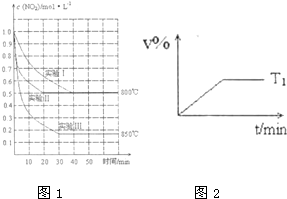 体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题:
体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题:(1)若该反应2NO2(g)?2NO(g)+O2(g)在体积不变的密闭容器中发 生,当反应达到平衡时,下列说法正确的是
A.2v正(NO2)=v逆(O2) B.v(NO)=2v(O2) C.气体的颜色不发生变化 D.气体的密度不再发生变化
E.反应物不再转化为生成物
(2)对比实验I、II和III,得出的下列结 论中正确的是
A.实验II和实验I相比,可能隐含 的反应条件是:反应容器的体积缩小 了
B.实验II和实验I相比,可能隐含的反应条件是:使用催化效率更商的催化剂
C.实验1条件该反应的平衡常数大于实验 III条件下该反应的平衡常数
D.对比实验
(3)右图2是在T1 0C时某密闭容器中NO的体积分数V%随时间t的变化曲线,请在图中补画出该反应在T2 0C 时(
T2>T1)时的NO体积分数随时t的变化曲线.
(4)若实验I达到平衡后,再向密闭容器中通入2moL
(5)若将实验m所得的平衡混合气体通入足甭的水中,欲使气体被完全吸收,则至少同时 通入标准状况下的空气
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)可逆反应到达平衡时,正逆速率相等,反应混合物各组分的浓度、含量不变,由此衍生的一些其它物理量不变,据此判断;
(2)实验Ⅱ和实验I相比,反应都从浓度为1.0mol/LNO2的分解开始建立平衡,温度相同,平衡时NO2的浓度相同,到达平衡的时间实验Ⅱ比实验I少,只能是实验Ⅱ使用催化剂;
对比实验Ⅰ和Ⅲ,实验Ⅲ温度升高,平衡时二氧化氮的浓度减少,平衡向正反应进行,升高温度平衡向吸热方向移动,平衡常数增大;
(3)升高温度到达平衡时间缩短,结合该反应的热效应判断升高温度对平衡的影响,确定升高温度平衡时NO的体积分数变化,据此作图;
(4)根据平衡常数和浓度商判断平衡移动,若平衡不移动根据定义计算新平衡时NO2的物质的量浓度,若平衡移动根据平衡常数计算新平衡时NO2的物质的量浓度;
(5)根据原子守恒实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收所需的氧气为NO2不分解时被水完全吸收所需要的氧气.
(2)实验Ⅱ和实验I相比,反应都从浓度为1.0mol/LNO2的分解开始建立平衡,温度相同,平衡时NO2的浓度相同,到达平衡的时间实验Ⅱ比实验I少,只能是实验Ⅱ使用催化剂;
对比实验Ⅰ和Ⅲ,实验Ⅲ温度升高,平衡时二氧化氮的浓度减少,平衡向正反应进行,升高温度平衡向吸热方向移动,平衡常数增大;
(3)升高温度到达平衡时间缩短,结合该反应的热效应判断升高温度对平衡的影响,确定升高温度平衡时NO的体积分数变化,据此作图;
(4)根据平衡常数和浓度商判断平衡移动,若平衡不移动根据定义计算新平衡时NO2的物质的量浓度,若平衡移动根据平衡常数计算新平衡时NO2的物质的量浓度;
(5)根据原子守恒实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收所需的氧气为NO2不分解时被水完全吸收所需要的氧气.
解答:
解:(1)A.到达平衡状态时,不同物质表示的正、逆速率之比等于化学计量数之比,2v正(NO2)=v逆(O2),即v正(NO2):v逆(O2)=1:2,不等于化学计量数之比2:1,逆反应速率较大,反应向逆反应进行,故A错误;
B.速率之比等于化学计量数之比,故B正确;
C.气体的颜色不发生变化,说明二氧化氮的浓度不再变化,可能反应到达平衡状态,故C正确;
D.混合气体的总质量不变,容器体积不变,混合气体的密度始终不变,故D正确;
E.可逆反应是动态平衡,平衡时反应没有停止,故E错误;
故答案为:BCD;
(2)A.实验Ⅱ和实验I相比,反应都从浓度为1.0mol/LNO2的分解开始建立平衡,温度相同,平衡时NO2的浓度相同,到达平衡的时间实验Ⅱ比实验I少,即条件改变只加快反应速率,不影响平衡移动,反应前后为气体体积减小的反应,故只能是实验Ⅱ使用催化剂,故A错误,
B.由A分析可知,实验Ⅱ使用催化剂,故B正确;
C.对比实验Ⅰ和Ⅲ,实验Ⅲ温度升高,平衡时二氧化氮的浓度减少,平衡向正反应进行,所以实验Ⅲ平衡常数更大,故C错误;
D.对比实验Ⅰ和Ⅲ,实验Ⅲ温度升高,平衡时二氧化氮的浓度减少,平衡向正反应进行,升高温度平衡向吸热方向移动,所以正反应为吸热反应,故D正确;
故答案为:BD;
(3)升高温度到达平衡时间缩短,该反应正反应为吸热反应,升高温度平衡向正反应移动,平衡时NO的体积分数变化增大,故在T2℃时( T2>T1)时的NO体积分数随时t的变化曲线为: ,
,
故答案为: ;
;
(4)实验Ⅰ中达平衡后,c(NO2)=0.5mol/L,则:
2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
开始(mol/L):1 0 0
变化(mol/L):0.5 0.5 0.25
平衡(mol/L):0.5 0.5 0.25
平衡常数k=
=0.25,
通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),此时为c(NO2)=0.5mol/L+
=1mol/L,c(NO)=0.5mol/L+
=1mol/L,c(O2)=0.25mol/L,
浓度商为Qc=
=0.25,等于平衡常数,所以平衡不移动;NO2的物质的量浓度为 1mol/L,
故答案为:不;1mol/L;
(5)由4NO2+O2 +2H2O=4HNO3,可知需要n(O2)=
n(NO2)=
×1mol/L×2L=0.5mol,所以需要氧气的最小体积为0.5mol×22.4L/mol=11.2L,需要空气的体积为11.2L÷
=56L,
故答案为:56.
B.速率之比等于化学计量数之比,故B正确;
C.气体的颜色不发生变化,说明二氧化氮的浓度不再变化,可能反应到达平衡状态,故C正确;
D.混合气体的总质量不变,容器体积不变,混合气体的密度始终不变,故D正确;
E.可逆反应是动态平衡,平衡时反应没有停止,故E错误;
故答案为:BCD;
(2)A.实验Ⅱ和实验I相比,反应都从浓度为1.0mol/LNO2的分解开始建立平衡,温度相同,平衡时NO2的浓度相同,到达平衡的时间实验Ⅱ比实验I少,即条件改变只加快反应速率,不影响平衡移动,反应前后为气体体积减小的反应,故只能是实验Ⅱ使用催化剂,故A错误,
B.由A分析可知,实验Ⅱ使用催化剂,故B正确;
C.对比实验Ⅰ和Ⅲ,实验Ⅲ温度升高,平衡时二氧化氮的浓度减少,平衡向正反应进行,所以实验Ⅲ平衡常数更大,故C错误;
D.对比实验Ⅰ和Ⅲ,实验Ⅲ温度升高,平衡时二氧化氮的浓度减少,平衡向正反应进行,升高温度平衡向吸热方向移动,所以正反应为吸热反应,故D正确;
故答案为:BD;
(3)升高温度到达平衡时间缩短,该反应正反应为吸热反应,升高温度平衡向正反应移动,平衡时NO的体积分数变化增大,故在T2℃时( T2>T1)时的NO体积分数随时t的变化曲线为:
 ,
,故答案为:
 ;
;(4)实验Ⅰ中达平衡后,c(NO2)=0.5mol/L,则:
2NO2(g)
 2NO(g)+O2(g)
2NO(g)+O2(g)开始(mol/L):1 0 0
变化(mol/L):0.5 0.5 0.25
平衡(mol/L):0.5 0.5 0.25
平衡常数k=
| 0.25×0.52 |
| 0.52 |
通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),此时为c(NO2)=0.5mol/L+
| 1mol |
| 2L |
| 1mol |
| 2L |
浓度商为Qc=
| 0.25×12 |
| 12 |
故答案为:不;1mol/L;
(5)由4NO2+O2 +2H2O=4HNO3,可知需要n(O2)=
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 5 |
故答案为:56.
点评:本题考查化学平衡图象、化学平衡影响因素、化学平衡常数、化学平衡的计算、读图提取信息能力,难度中等,是对学生综合能力的考查,(4)为易错点,注意利用平衡常数的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏加德罗常数的值.下列叙述错误的是( )
| A、常温常压下,0.17g NH3中含有的共用电子对数为0.1NA |
| B、常温常压下,1 L pH=1的稀H2SO4中含有的氢离子数为0.1NA |
| C、标准状况下,2.24 L Cl2与足量稀NaOH反应转移电子数为0.1NA |
| D、10 g由CaCO3与KHCO3组成的混合物中含有的碳原子数为0.1NA |
已知25℃时有关弱酸的电离平衡常数K1(H2Y)>K(HX)>K2(H2Y),则下列叙述不正确的是( )
| A、物质的量浓度相同时,各溶液的pH关系为pH(Na2Y)>pH(NaX)>pH(NaHY) |
| B、a mol/L HX溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(X-),则不一定a<b |
| C、在HX溶液中滴入Na2Y溶液,反应2HX+Y2-═2X-+H2Y成立 |
| D、若0.1 mol/L NaHY溶液呈酸性,则其水解能力小于电离能力 |
根据下列实验事实,判断微粒氧化性大小顺序正确的是( )
①FeCl3溶液中滴入KI溶液,加CCl4振荡,CCl4层呈紫色
②FeCl2溶液中滴加氯水,再加KSCN溶液,呈红色
③KMnO4溶液中滴加盐酸.KMnO4溶液的紫色褪去.
①FeCl3溶液中滴入KI溶液,加CCl4振荡,CCl4层呈紫色
②FeCl2溶液中滴加氯水,再加KSCN溶液,呈红色
③KMnO4溶液中滴加盐酸.KMnO4溶液的紫色褪去.
| A、MnO-4>Fe3+>Cl2>I2 |
| B、Cl2>I2>Fe3+>MnO4 |
| C、MnO-4>Cl2>Fe3+>I2 |
| D、Fe3+>MnO-4>Cl2>I2 |
由环己烷、乙醇、乙醚组成的混合物,经测定碳的质量分数为72%,则氧的质量分数为( )
| A、19.6% | B、17.8% |
| C、16% | D、14.2% |
下列说法正确的是( )
| A、硅酸钠溶液的保存和碱溶液一样,存放在橡胶塞密封的广口试剂瓶中 |
B、 用如图所示操作配制浓硫酸和浓硝酸的混酸 |
| C、用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| D、欲分离硝酸钾和氯化钠的混合物(物质的量比为1:1),先将样品溶解,然后加热至溶液表面出现晶膜后冷却,过滤得硝酸钾晶体;将滤液加热至有大量晶体析出后,用余热蒸干,得氯化钠晶体 |




 如图为配制250mL 0.2mol/L Na2CO3溶液的示意图.
如图为配制250mL 0.2mol/L Na2CO3溶液的示意图.