题目内容
15.化学电池的反应本质上属于( )| A. | 氧化还原反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
分析 化学电池是通过自发的氧化还原反应产生电子移动从而产生电流.
解答 解:化学电池是通过自发的氧化还原反应产生电子移动从而产生电流,所以化学电池的反应本质上属于氧化还原反应,故选:A.
点评 本题考查电池反应的原理,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
5.碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0,.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:
S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O82-):n(S2O32-)$>\frac{1}{2}$.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
表中Vx=2.0 ml,理由是保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的.
(3)已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成的锰离子有催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是C.
A.硫酸钾 B.氯化锰 C.硫酸锰 D.水.
已知:
S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O82-):n(S2O32-)$>\frac{1}{2}$.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验 序号 | 体积V/ml | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成的锰离子有催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是C.
A.硫酸钾 B.氯化锰 C.硫酸锰 D.水.
6. 黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )
黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )
 黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )
黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )| A. | AFBI分子中有2个手性碳原子 | B. | AFBI分子中所有原子处于同一平面 | ||
| C. | 1moIAFBI最多可与2moINaOH反应 | D. | 1molAFBI最多可与5molH2发生加成 |
3.某温度下反应N2O4(g)?2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是( )
①加压时(体积变小),将使正反应速率增大
②保持体积不变,加入少许NO2,将使正反应减小;
③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;
④保持体积不变,升高温度,再达平衡时颜色变深
⑤升高温度,正反应速率减小,平衡逆向移动.
①加压时(体积变小),将使正反应速率增大
②保持体积不变,加入少许NO2,将使正反应减小;
③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;
④保持体积不变,升高温度,再达平衡时颜色变深
⑤升高温度,正反应速率减小,平衡逆向移动.
| A. | ①④⑤ | B. | ③④⑤ | C. | ①③④ | D. | ①②③④⑤ |
10.某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )
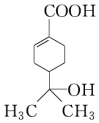

| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 该有机物的分子式为C10H16O3 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
20.在原电池和电解池的电极上所发生反应的类型相同的是( )
| A. | 原电池的正极和电解池阳极 | B. | 电解池阳极和电解池阴极 | ||
| C. | 原电池负极和电解池阳极 | D. | 原电池的正极和原电池负极 |
7.短周期的三种元素A、B、C在周期表中的位置关系如图,下列有关A、B、C三种元素的叙述中正确的是
( )
( )
| A | ||
| B | ||
| C |
| A. | A是一种活泼金属元素 | |
| B. | C的最高价氧化物的水化物是强酸 | |
| C. | B的氢氧化物是强碱 | |
| D. | C的最高价氧化物对应的水化物能与NaOH溶液反应 |
4.下列说法中正确的是( )
| A. | 烷烃中除甲烷外,很多烷烃都能被酸性KMnO4溶液氧化 | |
| B. | 烯烃、炔烃、苯都能发生化学反应使溴的四氯化碳溶液褪色 | |
| C. | 乙烯、乙炔、乙烷的分子中所有原子都在同一平面上 | |
| D. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 molH2O |
5.利用下图所示联合装置制备金属钛,下列叙述错误的是( )

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |