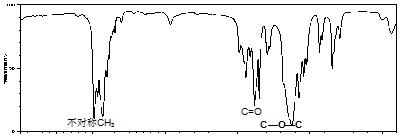
题目内容
6.某一定量的苯的同系物A完全燃烧,生成的气体通过浓硫酸后,浓硫酸增重5.4克,再通过KOH溶液后,KOH溶液增重19.8克,(设浓硫酸和KOH溶液的吸收率为100%).(1)通过计算确定A的分子式.(写出计算过程)
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好被2mol/L100mL的NaOH溶液完全中和.写出A可能的结构简式.
(3)若A的核磁共振氢谱中只有2种峰,则写出A的结构简式.
分析 (1)浓硫酸具有吸水性,增重5.4g,为水的质量,可求得烃中H原子个数,生成物通入KOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式;
(2)根据烃被酸性高锰酸钾氧化产物和氢氧化钠反应,可知A为苯的同系物,有两个取代基被氧化,据此写出结构简式;
(3)若A的核磁共振氢谱中只有2种峰,则有两种氢原子,据此写结构简式.
解答 解:(1)浓硫酸具有吸水性,增重5.4g,为水的质量,则n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=2n(H2O)=2×0.3mol=0.6mol,即0.05mol烃中含有0.6molH原子,所以该烃分子中H原子个数为12,生成物通入KOH溶液,增重的19.8g质量为二氧化碳的质量,则n(CO2)=$\frac{19.8g}{44g/mol}$=0.45mol,n(C)=n(CO2)=0.45mol,即0.05mol烃中含有0.45molC原子,所以该烃分子中C原子个数为9,所以该烃的分子式为C9H12,
答:该烃的分子式为C5H12;
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好2mol/L 100mL的NaOH溶液完全中和,可知有两个烷基被高锰酸钾氧化,为甲乙苯,有邻间对三种,故结构简式为: ,
,
答:A的结构简式为 ;
;
(3)若A的核磁共振氢谱中只有2种峰,则有两种氢,为均三甲苯,结构简式为 ,
,
答:A的结构简式为: .
.
点评 本题考查有机物分子式的确定和同分异构体的书写,题目难度不大,注意把握题中信息.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
4.“类推”常用的学习方法,但有时会产生错误结论.下列类推的结论中,正确的是( )
| A. | IVA族元素氢化物沸点顺序是GeH4>SiH4>CH4,则VA族元素氢化物沸点顺序也是AsH3>PH3>NH3 | |
| B. | 常见的氢化物是分子晶体,则所有氧化物都是分子晶体 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| D. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
11.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表所示:
由上述现象可推知c为:BaCl2(写化学式,后同),d为:Na2CO3,a与b反应的离子方程式为Ag++Cl-=AgCl↓.
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
18.用NA表示阿伏加德罗常数的值.下列叙述错误的是( )
| A. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L 已烷中含有共价键的数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中所含碳原子数为2NA | |
| D. | 足量Fe与1 mol Cl2充分反应,转移的电子数目为2NA |
15.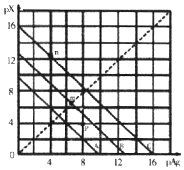 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线 | |
| B. | 坐标点p形成的溶液是AgCl的不饱和溶液 | |
| C. | m点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | n点表示由过量的KI与AgNO3反应产生AgI沉淀 |
16.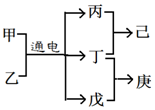 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )| A. | 原子半径Z>Y>X | |
| B. | 仅由这四种元素构成的溶液可能呈酸性、碱性或中性 | |
| C. | 己为由极性键构成的非极性分子 | |
| D. | 戊为一元弱碱 |
 (3)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图2:
(3)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图2: