题目内容
16. 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )| A. | 原子半径Z>Y>X | |
| B. | 仅由这四种元素构成的溶液可能呈酸性、碱性或中性 | |
| C. | 己为由极性键构成的非极性分子 | |
| D. | 戊为一元弱碱 |
分析 0.001mol•L-1的己溶液pH为3,则己为强酸,应为HCl,可知丙、丁分别为氢气、氯气,则甲、乙为饱和食盐水溶液,由转化关系可知丁为Cl2,丙为H2,戊为NaOH,庚为NaCl、NaClO的混合物,由此可知W为H、X为O、Y为Na、Z为Cl元素,以此解答该题.
解答 解:由以上分析可知W为H、X为O、Y为Na、Z为Cl,甲、乙为饱和食盐水溶液丁为Cl2,丙为H2,戊为NaOH,庚为NaCl、NaClO的混合物,己为HCl.
A.同周期元素从左到右原子半径减小,应为Na>Cl,故A错误;
B.仅由这四种元素构成的溶液,如为NaCl和HCl的混合溶液,则呈酸性,如为NaOH、NaCl的混合溶液,则呈碱性,如为NaCl的溶液,则呈中性,故B正确;
C.己为HCl,为极性分子,故C错误;
D.戊为NaOH,为强碱,故D错误;
故选B.
点评 本题考查无机物的推断,为高频考点,侧重分析与推断能力的考查,注意元素化合物知识的应用,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物为推断的突破口,题目难度不大.

练习册系列答案
相关题目
7.已知C(石墨)→C(金刚石)-Q,则可以判断( )
| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 一样稳定 | D. | 无法判断 |
11.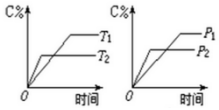 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
1.NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
8.化学与生产、生活密切相关.下列说法错误的是( )
| A. | 用CO2合成可降解塑料聚碳酸酯,实现“碳”的循环利用 | |
| B. | 由地沟油加工合成的“生物柴油”与柴油成分相同 | |
| C. | 高温消毒就是用加热的方法使蛋白质变性 | |
| D. | 海水提镁、炼铁、制造玻璃等工业都用到石灰石 |
5.某有机物的结构如图所示,下列说法错误的是( )


| A. | 分子式为C9H12O3,可以燃烧 | |
| B. | 能发生取代反应和聚合反应 | |
| C. | 能使酸性高锰酸钾溶液和溴的CCl4溶液褪色,褪色原理相同 | |
| D. | 分子中所有碳原子不可能共平面 |
16.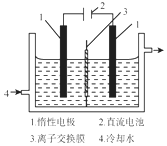 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
(1)碘是紫黑色(填颜色)固体物质,实验室常用升华的方法来分离提纯含有少量杂质的固体碘.
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为2I--2e-=I2;每生成1molKIO3,电路中通过的电子的物质的量为6mol.
(3)若用不同种电池作为上述实验的电源,请分析电池反应:
①铅蓄电池总反应的化学方程式为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2H2O+2H2SO4,则它在充电时的阳极反应为PbSO4(s)+2H2O-2e-═PbO2+4H++SO42-;
②MnO2-Zn组成碱性干电池在放电时的负极反应为Zn-2e-+2OH-═Zn(OH)2;
③以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.则该电池正极的电极反应为O2+2CO2+4e-═2CO32-;
④当产生相同质量的KIO3时,理论上,上述三种电池中分别消耗的Pb.Zn、丙烷的物质的量之比是10:10:1;
(4)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸.
(5)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:□→□→□→□→□→□→□
步骤②的操作名称是冷却结晶,步骤⑤的操作名称是干燥.步骤④洗涤晶体的目的是洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.(1)碘是紫黑色(填颜色)固体物质,实验室常用升华的方法来分离提纯含有少量杂质的固体碘.
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为2I--2e-=I2;每生成1molKIO3,电路中通过的电子的物质的量为6mol.
(3)若用不同种电池作为上述实验的电源,请分析电池反应:
①铅蓄电池总反应的化学方程式为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2H2O+2H2SO4,则它在充电时的阳极反应为PbSO4(s)+2H2O-2e-═PbO2+4H++SO42-;
②MnO2-Zn组成碱性干电池在放电时的负极反应为Zn-2e-+2OH-═Zn(OH)2;
③以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.则该电池正极的电极反应为O2+2CO2+4e-═2CO32-;
④当产生相同质量的KIO3时,理论上,上述三种电池中分别消耗的Pb.Zn、丙烷的物质的量之比是10:10:1;
(4)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸.
| 试验方法 | 实验现象及结论 |
步骤②的操作名称是冷却结晶,步骤⑤的操作名称是干燥.步骤④洗涤晶体的目的是洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.

 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.