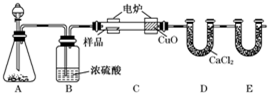
题目内容
18.用NA表示阿伏加德罗常数的值.下列叙述错误的是( )| A. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L 已烷中含有共价键的数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中所含碳原子数为2NA | |
| D. | 足量Fe与1 mol Cl2充分反应,转移的电子数目为2NA |
分析 A、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵0.1mol,0.1mol硝酸铵中含有0.2mol氮原子;
B、已烷在标准状况下是液体,气体摩尔体积不适用;
C.乙烯和丁烯的最简式为CH2,根据最简式计算混合气体中含有碳原子数;
D、1mol氯气与铁完全反应转移了2mol电子.
解答 解:A、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵的物质的量为0.1mol,0.1mol硝酸铵中含有0.2mol氮原子,含有的氮原子数为0.2NA,故A正确;
B、已烷在标准状况下是液体,气体摩尔体积不适用,所以无法求其物质的量,故B错误;
C.28.0 g乙烯和丁烯的混合气体中含有21.0g最简式CH2,含有最简式CH2的物质的量为:$\frac{28g}{14g/mol}$=2mol,该混合气体中含有2molC,所含的碳原子数目是2NA,故C正确;
D、1mol氯气与铁完全反应转移了2mol电子,所以足量Fe与1 mol Cl2充分反应,转移的电子数目为2NA,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,注意明确标况下气体摩尔体积的使用条件,选项B为易错点,注意题中数据.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
16.工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图:
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物A中的成分是SiO2和Cu.
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+.(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为3.2≤X<4.0.
(4)书写出由沉淀C制备铝的化学方程式:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.

已知:Cu2O+2H+═Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+.(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为3.2≤X<4.0.
(4)书写出由沉淀C制备铝的化学方程式:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
7.已知C(石墨)→C(金刚石)-Q,则可以判断( )
| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 一样稳定 | D. | 无法判断 |
8.化学与生产、生活密切相关.下列说法错误的是( )
| A. | 用CO2合成可降解塑料聚碳酸酯,实现“碳”的循环利用 | |
| B. | 由地沟油加工合成的“生物柴油”与柴油成分相同 | |
| C. | 高温消毒就是用加热的方法使蛋白质变性 | |
| D. | 海水提镁、炼铁、制造玻璃等工业都用到石灰石 |
 其中醛基(-CHO)可以用银氨溶液来检验.配制银氨溶液的方法是:向稀的AgNO3溶液中逐滴滴入稀氨水至使最初产生的白色沉淀刚好完全溶解.回答下列各题:
其中醛基(-CHO)可以用银氨溶液来检验.配制银氨溶液的方法是:向稀的AgNO3溶液中逐滴滴入稀氨水至使最初产生的白色沉淀刚好完全溶解.回答下列各题: .
.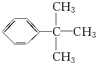 .
.