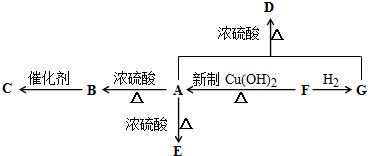
题目内容
某校化学小组学生进行“气体相对分子质量的测定”的实验.操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量,数据见下表(已换算成标准状况下的数值).
已知标准状况下,烧瓶的容积为0.293L,烧瓶和空气的总质量为48.421 2g,空气的平均相对分子质量为29.A、B、C、D、E是中学常见的气体.
(1)上述五种气体中,能够使品红溶液褪色的是(写化学式) .
(2)D的相对分子质量是 .
(3)在标准状况下,11.2L D气体中含有共用电子对的数目为 .
(4)A、B、C可能的化学式是 .
| 气体 | 烧瓶和气体的总质量(g) |
| A | 48.4082 |
| B | 48.4082 |
| C | 48.4082 |
| D | 48.4342 |
| E | 48.8762 |
(1)上述五种气体中,能够使品红溶液褪色的是(写化学式)
(2)D的相对分子质量是
(3)在标准状况下,11.2L D气体中含有共用电子对的数目为
(4)A、B、C可能的化学式是
考点:相对分子质量的测定
专题:实验设计题
分析:(1)能使品红褪色的是二氧化硫;
(2)根据公式m=nM=
M来计算各分子的相对分子质量;
(3)n=
计算出D的物质的量,结合D的结构式可计算共用电子对数;
(4)A、B、C的相对分子质量确定其分子式的可能情况.
(2)根据公式m=nM=
| V |
| Vm |
(3)n=
| V |
| Vm |
(4)A、B、C的相对分子质量确定其分子式的可能情况.
解答:
解:(1)根据题意,结合公式m=nM=
M来,所以48.421 2g-48.408 2g=[29-Mr(A)]g?mol-1×
,解得Mr(A)=28,
则Mr(B)=Mr(C)=Mr(A)=28,同理48.421 2g-48.4342g=[29-Mr(D)]g?mol-1×
,解得Mr(D)=30,48.421 2g-48.8762=[29-Mr(E)]g?mol-1×
,
解得Mr(E)=64,相对分子质量为28的气体可能有C2H4、CO、N2等,相对分子质量为64的气体为SO2,相对分子质量为30的气体为C2H6,这些气体中,能使品红褪色的是二氧化硫,故答案为:SO2;
(2)根据(1)的分析知道:D的相对分子质量是30,故答案为:30;
(3)1.12L乙烷的物质的量为:
=0.05mol,乙烷的结构简式为CH3CH3,含6个C-H键,一个C-C键,故含共用电子对数为:0.05mol×7×NA=0.35NA;
故答案为:0.35NA;
(4)根据(1)的分析,Mr(B)=Mr(C)=Mr(A)=28,可以是C2H4、CO、N2,故答案为:C2H4、CO、N2.
| V |
| Vm |
| 0.293L |
| 22.4L/mol |
则Mr(B)=Mr(C)=Mr(A)=28,同理48.421 2g-48.4342g=[29-Mr(D)]g?mol-1×
| 0.293L |
| 22.4L/mol |
| 0.293L |
| 22.4L/mol |
解得Mr(E)=64,相对分子质量为28的气体可能有C2H4、CO、N2等,相对分子质量为64的气体为SO2,相对分子质量为30的气体为C2H6,这些气体中,能使品红褪色的是二氧化硫,故答案为:SO2;
(2)根据(1)的分析知道:D的相对分子质量是30,故答案为:30;
(3)1.12L乙烷的物质的量为:
| 1.12L |
| 22.4L/mol |
故答案为:0.35NA;
(4)根据(1)的分析,Mr(B)=Mr(C)=Mr(A)=28,可以是C2H4、CO、N2,故答案为:C2H4、CO、N2.
点评:本题是一道关于相对分子是量测定的知识题目,考查学生分析和解决问题的能力,难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目



 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )