题目内容
硝酸铵不仅是一种重要的氮肥,而且还可制成炸药,应用于军事和采矿等方面.工业上制取硝酸铵的流程图如图,请同答下列问题:
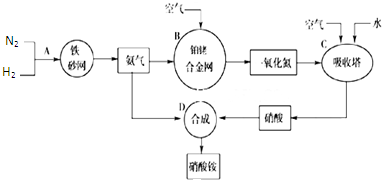
(1)此生产过程中,H2的来源是水煤气,该反应的方程式为 ,合成氨的原料气在使用前需要净化,目的是 .
(2)在合成氨的过程中,采取压强为10-30MPa是为了 ;在合成硝酸的吸收塔中通入足量空气的目的是 .
(3)在上述工业制硝酸的生产中,B设备中发生反应的化学方程式为 .
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O
还原法:8NH3+6NO2
2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 .
(5)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3,所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %.
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:

(1)此生产过程中,H2的来源是水煤气,该反应的方程式为
(2)在合成氨的过程中,采取压强为10-30MPa是为了
(3)在上述工业制硝酸的生产中,B设备中发生反应的化学方程式为
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O
还原法:8NH3+6NO2
| ||
| △ |
以上两种方法中,符合绿色化学的是
(5)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3,所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| 注意事项 | 理由 | |
| ① | ||
| ② |
考点:工业合成氨,工业制取硝酸
专题:氮族元素
分析:(1)根据工业生产中,氢气来自水煤气,反应原理是:C+H2O
CO+H2;为防止催化剂中毒,必须对原料进行净化;
(2)由外界条件对化学平衡以及化学反应速率的影响分析;
(3)装置B是氨催化氧化反应,是氨气在催化剂铂铑合金作用下被氧气氧化为一氧化氮的反应;
(4)据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(5)根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数;
(6)硝酸铵受撞击时易分解产生气体,在有限空间内,气体急速膨胀,易爆炸.
| ||
(2)由外界条件对化学平衡以及化学反应速率的影响分析;
(3)装置B是氨催化氧化反应,是氨气在催化剂铂铑合金作用下被氧气氧化为一氧化氮的反应;
(4)据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(5)根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数;
(6)硝酸铵受撞击时易分解产生气体,在有限空间内,气体急速膨胀,易爆炸.
解答:
解:(1)根据工业生产中,氢气来自水煤气,反应原理是:C+H2O
CO+H2;工业上在合成氨的过程中,必须对原料进行净化,防止催化剂铁触媒中毒,而减小催化活性,故答案为:C+H2O
CO+H2;防止催化剂中毒;
(2)合成氨反应的化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,反应物气体的化学计量数大于生成物气体的化学计量数,则加压有利于平衡正向移动,提高原料气的转化率,升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间.
合成硝酸的吸收塔中通入空气的目的是利用一氧化氮和氧气按照4:3全部反应生成硝酸;4NO+3O2+2H2O=4HNO3,可使NO循环利用,全部转化成HNO3;
故答案为:加压使化学反应速率加快,有利于平衡正向移动,提高原料气的转化率;可使NO循环利用,全部转化成HNO3;
(3)装置B是氨催化氧化反应:氨气在催化剂作用下被氧气氧化为一氧化氮的反应,反应的化学方程式为:4NH3+5O2
4NO+6H2O;
故答案为:4NH3+5O2
4NO+6H2O;
(4)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2
7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,故答案为:氨气还原法;
(5)由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为
×100%=53.1%;即制HNO3所用去的NH3的质量占总耗NH3质量的53.1%,故答案为:53.1;
(6)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击,NH4NO3
N2O↑+2H2O;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失;
①不能与碱性肥料混施;硝酸铵溶液呈碱性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失;
故答案为:①不能与碱性肥料混施;硝酸铵溶液呈碱性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失(任选两条).
| ||
| ||
(2)合成氨反应的化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,反应物气体的化学计量数大于生成物气体的化学计量数,则加压有利于平衡正向移动,提高原料气的转化率,升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间.
合成硝酸的吸收塔中通入空气的目的是利用一氧化氮和氧气按照4:3全部反应生成硝酸;4NO+3O2+2H2O=4HNO3,可使NO循环利用,全部转化成HNO3;
故答案为:加压使化学反应速率加快,有利于平衡正向移动,提高原料气的转化率;可使NO循环利用,全部转化成HNO3;
(3)装置B是氨催化氧化反应:氨气在催化剂作用下被氧气氧化为一氧化氮的反应,反应的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(4)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2
| ||
| △ |
(5)由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为
| 1mol |
| 1mol+0.8832mol |
(6)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击,NH4NO3
| ||
①不能与碱性肥料混施;硝酸铵溶液呈碱性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失;
故答案为:①不能与碱性肥料混施;硝酸铵溶液呈碱性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失(任选两条).
点评:本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行简单计算,使用硝酸铵的注意事项,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
下列系统命名法不正确的是( )
| A、2-甲基-4-乙基戊烷 |
| B、2,3-二乙基-1-戊烯 |
| C、2-甲基丙醇 |
| D、1,4-二甲基苯 |
有关下列四个常用电化学装置的叙述中,正确的是( )
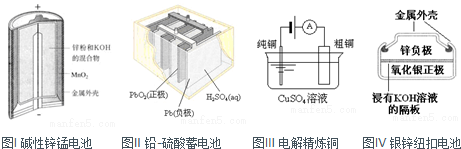

| A、图I所示电池中,的作用是催化剂 |
| B、图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C、图Ⅲ所示装置工作过程中,电解质溶液中浓度始终不变 |
| D、图IV所示电池中,是氧化剂,电池工作过程中还原为Ag |
下列离子方程式书写正确的是( )
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下4.6g NO2和N2O4混合气体所含原子总数为0.3NA |
| B、标准状况下,22.4L SO3的分子数为NA |
| C、1molFe在22.4L的Cl2(标准状况下)燃烧,转移的电子总数为3NA |
| D、电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
自保定市被世界自然基金会选定为“中国低碳城市发展项目”的首批试点城市之后,“低碳”已经走进百姓生活、城市建设以及经济发展等各个领域,下列有关说法不正确的是( )
| A、太阳能、地热能、核能等均属于新能源 |
| B、“低碳”是指采用含碳量低的烃类化合物作燃料 |
C、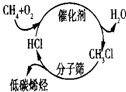 甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想 |
| D、减少化石能源的使用能减少CO2的排放量 |