题目内容
某研究性学习小组探究下列化学反应的特征:
(I)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(Ⅱ)FeS+HNO3→Fe(NO3)3+Fe2(SO4)3+NO2↑+N2O4↑+NO↑+H2O
(Ⅲ)CuSO4→CuO+SO3↑+SO2↑+O2↑
(Ⅳ)CO2+KOH→KHCO3+K2CO3+H2O
(1)大多数化学反应中物质的化学计量数之比是固定的,但上述化学反应的化学计量数之比是不确定的,即物质的化学计量数有多组.根据上述实例,请用一句话归纳化学计量数有多组的化学反应的特点: .
(2)反应(Ⅱ)中还原产物是 ,若其物质的量之比确定,该反应的化学计量数也随之确定.
(3)有人认为反应(Ⅲ)是两个反应式加合的结果,请分析它是哪两个化学反应加合而成的: 、 .在反应(Ⅲ)中,根据电子转移守恒,物质 和 的物质的量之比是固定的.
(4)若将16gCuSO4固体粉末按反应(Ⅲ)完全分解,最终气体产物的物质的量的取值范围是: .
(5)若反应(Ⅳ)中KHCO3、K2CO3的化学计量数分别为a、b,则用a、b表示该反应的化学计量数的化学方程式是 .
(I)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(Ⅱ)FeS+HNO3→Fe(NO3)3+Fe2(SO4)3+NO2↑+N2O4↑+NO↑+H2O
(Ⅲ)CuSO4→CuO+SO3↑+SO2↑+O2↑
(Ⅳ)CO2+KOH→KHCO3+K2CO3+H2O
(1)大多数化学反应中物质的化学计量数之比是固定的,但上述化学反应的化学计量数之比是不确定的,即物质的化学计量数有多组.根据上述实例,请用一句话归纳化学计量数有多组的化学反应的特点:
(2)反应(Ⅱ)中还原产物是
(3)有人认为反应(Ⅲ)是两个反应式加合的结果,请分析它是哪两个化学反应加合而成的:
(4)若将16gCuSO4固体粉末按反应(Ⅲ)完全分解,最终气体产物的物质的量的取值范围是:
(5)若反应(Ⅳ)中KHCO3、K2CO3的化学计量数分别为a、b,则用a、b表示该反应的化学计量数的化学方程式是
考点:探究化学反应机理
专题:元素及其化合物
分析:(1)联系题目中的(1)和(3)可以得出化学计量数有多组的化学反应的特点;
(2)依据还原产物是氧化剂得到电子,化合价降低后得到的产物判断还原产物即可;
(3)依据化学反应特点找出组合即可;
(4)依据化学反应计算范围即可;
(5)依据元素守恒得出化学反应方程式即可.
(2)依据还原产物是氧化剂得到电子,化合价降低后得到的产物判断还原产物即可;
(3)依据化学反应特点找出组合即可;
(4)依据化学反应计算范围即可;
(5)依据元素守恒得出化学反应方程式即可.
解答:
解:(1)由(3)题中暗示可知,化学计量数有多组的化学反应的特点为一个反应可视为2个或多个反应的加合,故答案为:一个反应可视为2个或多个反应的加合;
(2)根据化合价降低的是氧化剂,我们知道HNO3是氧化剂,氧化剂在化学反应中被还原,生产的物质是还原产物,故答案为:NO2、N2O4、NO;
(3)化学反应在加合时,反应物和反应物加合,生成物和生成物加合,故答案为:CuSO4?CuO+SO3↑;2SO3
2SO2+O2,SO2和O2;
(4)依据硫酸铜的分子量是160,我们可以计算16gCuSO4固体粉末的物质的量是:
=0.1moL,根据CuSO4?CuO+SO3↑,则气体的物质的量为最小,即0.1mol,依据配平以后的化学反应4CuSO4=4CuO+2SO3↑+2SO2↑+O2↑可以计算最多产生气体为0.15mol,故答案为:(0.1,0.15);
(5)根据反应前后原子的种类和数目不变,可以将CO2+KOH→KHCO3+K2CO3+H2O配平为:(a+b)CO2+(a+2b)KOH=aKHCO3+bK2CO3+(
+b)H2O,故答案为:(a+b)CO2+(a+2b)KOH=aKHCO3+bK2CO3+(
+b)H2O.
(2)根据化合价降低的是氧化剂,我们知道HNO3是氧化剂,氧化剂在化学反应中被还原,生产的物质是还原产物,故答案为:NO2、N2O4、NO;
(3)化学反应在加合时,反应物和反应物加合,生成物和生成物加合,故答案为:CuSO4?CuO+SO3↑;2SO3
| ||
(4)依据硫酸铜的分子量是160,我们可以计算16gCuSO4固体粉末的物质的量是:
| 16g |
| 160g/mol |
(5)根据反应前后原子的种类和数目不变,可以将CO2+KOH→KHCO3+K2CO3+H2O配平为:(a+b)CO2+(a+2b)KOH=aKHCO3+bK2CO3+(
| a |
| 2 |
| a |
| 2 |
点评:本题重点围绕化学反应前后原子的种类和数目不变考查学生们的配平能力,是一道不错的题目.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
下列离子方程式书写正确的是( )
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
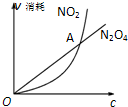 已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )
已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )| A、图中A点对应的状态表示该反应达到化学平衡 |
| B、若某温度时k1=k2,则该温度下反应的平衡常数K=0.5 |
| C、在1L密闭容器中充入1 mol NO2,平衡时:c(NO2)+c(N2O4)=1 mol?L-1 |
| D、在1L密闭容器中充入1 mol NO2,当c(NO2)=c(N2O4)时,NO2的转化率是33.3% |
固体粉末X中可能含有Fe、Fe2O3、MnO2、CuO、K2SiO3、K2SO3、NaNO2、KAlO2中的若干种.某同学为确定该固体粉末的成分,取X进行连续实验:以下说法正确的是( )
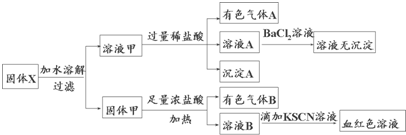

| A、溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2 |
| B、由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 |
| C、气体A和气体B一定均为纯净物 |
| D、原混合物中一定含有Fe2O3 |
下列各原子或离子的电子排布式错误的是( )
| A、C 1s22s22p2 |
| B、O2- 1s22s22p6 |
| C、Cr 1s22s22p63s23p63d44s2 |
| D、Al 3+ 1s22s22p6 |
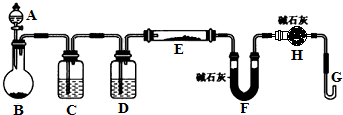 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题: