题目内容
 (1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为
(1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为(2)将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
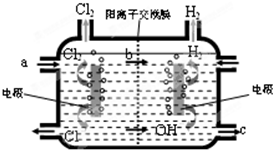
(3)如图为工业上氯碱工业的电解槽示意图,据图回答:①图中a、b、c处物质名称分别是:a
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为
(4)反应2A
①若温度升高,平衡向正反应方向移动,则正反应是
②若B为固体,降低压强平衡向逆反应方向移动,则A呈
③若A是气态时,加压时,平衡不移动,则B为
考点:原电池和电解池的工作原理,热化学方程式,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)甲醇在常温下为液体,其热值为22.7kJ?g-1,则1mol甲醇完全燃烧放出的热量为22.7kJ?g-1×32g=726.4kJ,据此书写其热化学反应方程式;
(2)燃料电池中,正极上氧化剂得电子发生还原反应;
(3)①工业上用电解饱和食盐水制取氯碱,在阳极区域加入饱和食盐水,在阴极区域生成氢氧化钠,阳离子交换膜只能阳离子通过;
②氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠;
(4)①升高温度,化学平衡向吸热反应方向移动;
②减小压强,平衡向气体体积增大方向移动;
③加压时,平衡不移动,说明该反应前后气体计量数之和不变.
(2)燃料电池中,正极上氧化剂得电子发生还原反应;
(3)①工业上用电解饱和食盐水制取氯碱,在阳极区域加入饱和食盐水,在阴极区域生成氢氧化钠,阳离子交换膜只能阳离子通过;
②氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠;
(4)①升高温度,化学平衡向吸热反应方向移动;
②减小压强,平衡向气体体积增大方向移动;
③加压时,平衡不移动,说明该反应前后气体计量数之和不变.
解答:
解:(1)甲醇在常温下为液体,其热值为22.7kJ?g-1,则1mol甲醇完全燃烧放出的热量为22.7kJ?g-1×32g=726.4kJ,其热化学方程式为CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.4 kJ?mol-1 ,
故答案为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.4 kJ?mol-1 ;
(2)碱性甲醇燃料电池中,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-+=CO32-+6H2O,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(3)①工业上用电解饱和食盐水制取氯碱,在阳极区域加入饱和食盐水,氯离子在阳极上放电生成氯气,阴极上氢离子放电生成氢气,同时电极附近有氢氧化钠生成,所以在阴极区域产生氢氧化钠,阳离子交换膜只能阳离子通过,钠离子通过离子交换膜进入阴极区,
故答案为:饱和食盐水;钠离子;氢氧化钠溶液;
②阳极上生成的氯气和阴极区域生成的氢氧化钠反应生成氯化钠和次氯酸钠,反应方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(4)①升高温度,化学平衡向吸热反应方向移动,若温度升高,平衡向正反应方向移动,则正反应是吸热反应,故答案为:吸;
②减小压强,平衡向气体体积增大方向移动,若B为固体,降低压强平衡向逆反应方向移动,说明A是气态、C可以是三种状态,故答案为:气;
③加压时,平衡不移动,说明该反应前后气体计量数之和不变,若A是气态时,加压时,平衡不移动,则B、C都是气态,故答案为:气;气.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)碱性甲醇燃料电池中,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-+=CO32-+6H2O,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(3)①工业上用电解饱和食盐水制取氯碱,在阳极区域加入饱和食盐水,氯离子在阳极上放电生成氯气,阴极上氢离子放电生成氢气,同时电极附近有氢氧化钠生成,所以在阴极区域产生氢氧化钠,阳离子交换膜只能阳离子通过,钠离子通过离子交换膜进入阴极区,
故答案为:饱和食盐水;钠离子;氢氧化钠溶液;
②阳极上生成的氯气和阴极区域生成的氢氧化钠反应生成氯化钠和次氯酸钠,反应方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(4)①升高温度,化学平衡向吸热反应方向移动,若温度升高,平衡向正反应方向移动,则正反应是吸热反应,故答案为:吸;
②减小压强,平衡向气体体积增大方向移动,若B为固体,降低压强平衡向逆反应方向移动,说明A是气态、C可以是三种状态,故答案为:气;
③加压时,平衡不移动,说明该反应前后气体计量数之和不变,若A是气态时,加压时,平衡不移动,则B、C都是气态,故答案为:气;气.
点评:本题考查较综合,涉及热化学方程式的书写、电解原理、化学平衡等知识点,难点是确定(3)中a、b、c物质,根据交换膜、放电的氯气分析解答,会正确书写电极反应式,题目难度中等.

练习册系列答案
相关题目
反应N2(g)+3H2(g)?2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是( )
| A、增加氮气的量,平衡正向移动,上式中△H增大 |
| B、增大压强,平衡正向移动,平衡常数增大 |
| C、升高温度,平衡逆向移动,正反应速率增大 |
| D、加入催化剂,反应速率增大,氢气转化率增大 |
已知X(g)+3Y(g)═2Z(g)△H>0,下列对该反应的说法中正确的是( )
| A、△S>0 |
| B、逆向能自发进行,且反应速率和平衡常数均较大 |
| C、反应物总能量大于生成物总能量 |
| D、在任何温度下都不能自发进行 |
下列说法中,正确的是( )
A、 -OH与 -OH与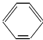 -CH2OH互为同系物 -CH2OH互为同系物 |
| B、乙醇和乙醚互为同分异构体 |
| C、乙醇、乙二醇、丙三醇互为同系物 |
| D、可用浓溴水来区分乙醇苯酚 |
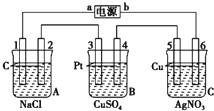 如图,通电5min后,电极5质量增加2.16g,回答:
如图,通电5min后,电极5质量增加2.16g,回答: 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物. 如图所示,组成一个原电池.
如图所示,组成一个原电池.