题目内容
已知X(g)+3Y(g)═2Z(g)△H>0,下列对该反应的说法中正确的是( )
| A、△S>0 |
| B、逆向能自发进行,且反应速率和平衡常数均较大 |
| C、反应物总能量大于生成物总能量 |
| D、在任何温度下都不能自发进行 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、正反应气体体积减小;
B、据逆反应的△H-T△S的大小判断;
C、正反应吸热;
D、据正反应的△H-T△S的大小判断;
B、据逆反应的△H-T△S的大小判断;
C、正反应吸热;
D、据正反应的△H-T△S的大小判断;
解答:
解:A、正反应的气体体积减小,熵减小,△S<0,故A错误;
B、逆反应的△H<0△S>0,所以其△H-T△S<0,反应能够自发进行,逆反应放热温度升高,反应速率加快,但逆反应平衡常数不一定大,故B错误;
C、正反应吸热,反应物总能量低于生成物总能量,故C错误;
D、正反应的△H>0△S<0,所以其△H-T△S>0,在任何温度下都不能自发进行,故D正确;
故选D.
B、逆反应的△H<0△S>0,所以其△H-T△S<0,反应能够自发进行,逆反应放热温度升高,反应速率加快,但逆反应平衡常数不一定大,故B错误;
C、正反应吸热,反应物总能量低于生成物总能量,故C错误;
D、正反应的△H>0△S<0,所以其△H-T△S>0,在任何温度下都不能自发进行,故D正确;
故选D.
点评:本题考查了熵变以及反应自发进行的条件,题目难度中等.

练习册系列答案
相关题目
下列说法或表示方法正确的是( )
| A、等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 |
| B、由C(石墨)→C(金刚石)△H=+11.9kJ?mol-1可知,金刚石比石墨稳定 |
| C、在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1 |
| D、H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ |
在下列溶液中,各组离子一定能够大量共存的是( )
| A、使酚酞试液变红的溶液中:Na+ Cl- SO42- Fe3+ |
| B、c(H+)=10-12mol/L的溶液:K+ Ba2+ Cl- Br- |
| C、使紫色石蕊试液变红的溶液中:Fe2+ Mg2+ NO3- Cl- |
| D、碳酸氢钠溶液:K+ SO42- Cl- H+ |
下列平衡体系,保持温度一定时,改变压强颜色会改变,但平衡并不移动,这个反应是( )
| A、2NO(g)+O2(g)?2NO2(g) |
| B、N2O4 (g)?2NO2(g) |
| C、Br2(g)+H2(g)?2HBr(g) |
| D、6NO(g)+4NH3(g)?5N2(g)+3H2O(g) |
已知某种有机化合物的结构简式如图,下列说法正确的是( )
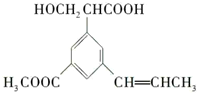

| A、该有机物的一个分子中属于不饱和碳原子的有6个,属于饱和碳原子的有8个 |
| B、该分子能与浓溴水反应生成白色沉淀 |
| C、1 mol该有机物与足量NaOH或H2反应,最多消耗2 mol NaOH,6 mol H2 |
| D、推测该有机物可能发生的反应有:加成反应、氧化反应、消去反应、水解反应、酯化反应 |
已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g?mL-1,要从水与丙酮的混合物里将丙酮分离出来,下列方法中最合理的是( )
| A、分液 | B、蒸馏 | C、过滤 | D、蒸发 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、23g钠在氧气中完全燃烧失去电子数为0.5NA |
| B、标准状况下,22.4L己烷中共价键数目为19NA |
| C、32g O3和O2的混合气体中共有2NA个氧原子 |
| D、6.8g熔融的KHSO4中含有0.1NA个阳离子 |
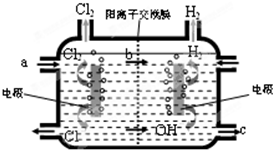 (1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为
(1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为