题目内容
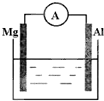 如图所示,组成一个原电池.
如图所示,组成一个原电池.(1)当电解质溶液为稀硫酸时:
①Mg电极是
②Al电极的其电极反应为
(2)当电解质溶液为氢氧化钠溶液时:
①Mg电极是
②Al电极是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)当电解质溶液为稀硫酸时,Mg易失电子作负极、Al正极,负极镁被氧化,正极上氢离子得电子发生还原反应;
(2)当电解质溶液为氢氧化钠溶液时,该装置能自发进行氧化还原反应,能构成原电池,Al作负极、Mg作正极.
(2)当电解质溶液为氢氧化钠溶液时,该装置能自发进行氧化还原反应,能构成原电池,Al作负极、Mg作正极.
解答:
解:(1)当电解质溶液为稀硫酸时,由于镁、铝都能与硫酸反应,且镁比铝活泼,则
①镁电极为负极,发生氧化反应,电极方程式为Mg-2e-=Mg2+,故答案为:负;Mg-2e-=Mg2+;
②铝为原电池的正极,发生还原反应,电极方程式为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;还原;
(2)当电解质溶液为氢氧化钠溶液时,只有铝能与氢氧化钠溶液反应,则铝为负极,镁为正极,
①镁为正极,发生还原反应,电极方程式为2H2O+2e-=2OH-+H2↑,故答案为:正;2H2O+2e-=2OH-+H2↑;
②Al为负极,发生氧化反应,电极方程式为2Al-6e-+8OH-=2AlO2-+4H2O,故答案为;负;2Al-6e-+8OH-=2AlO2-+4H2O.
①镁电极为负极,发生氧化反应,电极方程式为Mg-2e-=Mg2+,故答案为:负;Mg-2e-=Mg2+;
②铝为原电池的正极,发生还原反应,电极方程式为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;还原;
(2)当电解质溶液为氢氧化钠溶液时,只有铝能与氢氧化钠溶液反应,则铝为负极,镁为正极,
①镁为正极,发生还原反应,电极方程式为2H2O+2e-=2OH-+H2↑,故答案为:正;2H2O+2e-=2OH-+H2↑;
②Al为负极,发生氧化反应,电极方程式为2Al-6e-+8OH-=2AlO2-+4H2O,故答案为;负;2Al-6e-+8OH-=2AlO2-+4H2O.
点评:本题考查原电池原理,为高频考点,把握原电池的工作原理为解答的关键,侧重电极、电极反应的考查,注意不能直接利用金属活泼性判断负极,应从氧化还原反应的角度考虑,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
在①金属铁 ②氯化铵 ③硝酸钾 ④单质碘 ⑤二氧化硅 ⑥烧碱 ⑦盐酸 ⑧氧化钙中,属于金属单质的是 (填序号,下同);属于非金属单质的是 ;属于盐的是 ;属于碱的是 ;属于酸的是 ;属于氧化物的是 .
下列离子方程式中,正确的是( )
| A、向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| B、将氯气通入KI溶液中:Cl2+2I-═2Cl-+I2 |
| C、将氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ |
| D、将锌粒投入稀硝酸中:Zn+2H+=Zn2++H2↑ |
下列属于同位素的一组是( )
| A、金刚石和石墨 |
| B、Na2O和Na2O2 |
| C、1H、2H、3H |
| D、40K、40Ca |
 (1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为
(1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下: