题目内容
 (1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/molC(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H
①下列情形不能说明该反应已达到平衡状态的是
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
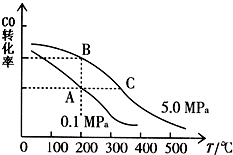
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率=
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质.负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素,化学平衡状态的判断,化学平衡的计算
专题:
分析:(1)根据盖斯定律构造出目标反应热化学反应方程式,据此计算反应热,注意化学计量数乘以不同的系数,进行加减,焓变也要乘以相同的系数,做相应加减;
(2)①达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
②化学反应的平衡常数随着温度的变化而变化,根据压强恒定,温度变化引起化学平衡移动的方向来判断化学反应的吸放热情况;
③根据化学反应三段式来计算转化率和平衡常数;
(3)该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应.
(2)①达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
②化学反应的平衡常数随着温度的变化而变化,根据压强恒定,温度变化引起化学平衡移动的方向来判断化学反应的吸放热情况;
③根据化学反应三段式来计算转化率和平衡常数;
(3)该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应.
解答:
解:(1)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,
②C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol,
根据盖斯定律,①-②得CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8kJ/mol,
故答案为:-524.8;
(2)①A.每消耗1molCO的同时生成2molH2,能证明正逆反应速率是相等的,故A错误;
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故D错误.
故选C;
②根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,根据图示内容,压强不变,当温度升该时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,所以该反应是一个放热反应,故答案为:=;<;
③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度(mol/L) 1.0 3.0 0
变化浓度(mol/L) 0.75 1.5 0.75
平衡浓度(mol/L) 0.25 1.5 0.75
CO的转化率
×100%=75%,此温度下的化学平衡常数K=
=
≈1.3;
故答案为:75%;1.3;
(3)解:该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-;
故答案为:O2+4e-+2CO2=2CO32-.
②C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol,
根据盖斯定律,①-②得CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8kJ/mol,
故答案为:-524.8;
(2)①A.每消耗1molCO的同时生成2molH2,能证明正逆反应速率是相等的,故A错误;
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故D错误.
故选C;
②根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,根据图示内容,压强不变,当温度升该时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,所以该反应是一个放热反应,故答案为:=;<;
③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度(mol/L) 1.0 3.0 0
变化浓度(mol/L) 0.75 1.5 0.75
平衡浓度(mol/L) 0.25 1.5 0.75
CO的转化率
| 0.75 |
| 1 |
| c(CH3OH) |
| c(CO)?c(H2)3 |
| 0.75 |
| 0.25×1.52 |
故答案为:75%;1.3;
(3)解:该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-;
故答案为:O2+4e-+2CO2=2CO32-.
点评:本题主要考查了盖斯定律的运用、化学平衡状态的判断、化学平衡常数、转化率以及电极反应式的书写等,注意三段式在计算中的应用,根据正负极上得失电子结合电解质书写电极反应式,难度不大.

练习册系列答案
相关题目
化学用语是学习化学的工具和基础.下列有关化学用语的使用正确的是( )
| A、纯碱溶液呈碱性的原因是:CO32-+2H2O=H2CO3+2OH- | ||||
B、用惰性电极电解MgCl2溶液:Mg2++2Cl-+2H2O
| ||||
| C、乙烯的结构简式:CH2CH2 | ||||
| D、在原电池和电解池中均可发生的电极反应:4OH--4e-=O2↑+2H2O |
下列说法正确的是( )
| A、实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗 |
| B、用pH试纸测定溶液pH时,通常是将pH试纸放入待测溶液中润湿后,半分钟内跟标准比色卡比较 |
| C、重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 |
| D、用丁达尔现象可鉴别蛋白质溶液、淀粉溶液和葡萄糖溶液 |
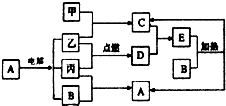 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).