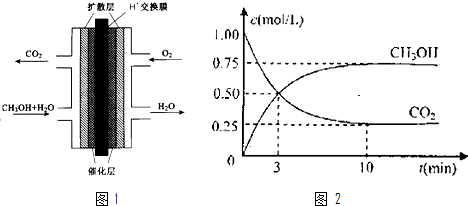
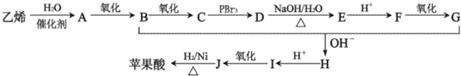
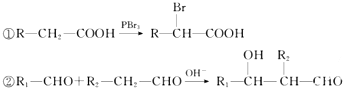
题目内容
主族元素X、Y、Z的离子的电子层结构相同,原子半径X>Z,离子半径Y>X,Y和Z能形成离子化合物,由此可判断三种元素的原子序数是( )
| A、X>Y>Z |
| B、Z>Y>X |
| C、Y>X>Z |
| D、X>Z>Y |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:X、Y、Z三种主族元素的离子具有相同的电子层结构,则三种离子的核外电子数相等,核外电子数一样,原子核内质子数越多则离子半径越小,电子层越多,原子半径越大.
解答:
解:X、Y、Z三种元素的离子具有相同的电子层结构,则三种离子的核外电子数相等,根据原子半径X>Z,原子的电子层越多,原子半径越大,所以原子序数是X>Z;
由离子半径Y>X,如果离子的核外电子数一样,则核内质子数越多则半径越小,所以原子序数是Y>Z,Y和Z能形成离子化合物,则Y为金属元素,Z为非金属元素,则原子序数:Y>Z,
即三种元素的原子序数关系是X>Y>Z.
故选A.
由离子半径Y>X,如果离子的核外电子数一样,则核内质子数越多则半径越小,所以原子序数是Y>Z,Y和Z能形成离子化合物,则Y为金属元素,Z为非金属元素,则原子序数:Y>Z,
即三种元素的原子序数关系是X>Y>Z.
故选A.
点评:本题考查微粒半径大小与结构的关系,难度中等,正确把握原子序数与原子半径的关系是关键,注意把握微粒大小比较规律.

练习册系列答案
相关题目
反应2SO2+O2
2SO3+Q达到化学平衡状态时的标志是( )
| 催化剂 |
| A、SO2的消耗速率等于SO3的生成速率 |
| B、SO2的生成速率等于SO3的生成速率 |
| C、SO2的消耗速率大于O2生成速率的2倍 |
| D、SO3的生成速率等于O2的生成速率 |
下列有关热化学方程式的书写及对应的表述均正确的是( )
| A、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ?mol-1 |
| B、稀醋酸与0.1 mol?L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| C、已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的燃烧热△H=-110.5 kJ?mol-1 |
有反应4HCl+O2→2Cl2+2H2O,已知2molO2被还原时,放出a kJ的热量,且知断开1mol
O2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量.则断开1mol H-O键比断开1molH-Cl 键所需能量高( )
O2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量.则断开1mol H-O键比断开1molH-Cl 键所需能量高( )
A、
| ||
B、
| ||
C、
| ||
D、
|
已知NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B、镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
| C、电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为NA |
| D、在lL0.lmol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
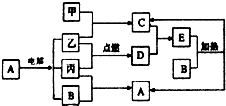 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).