题目内容
12.根据表提供的数据,下列判断正确的是( )| 化学式 | 电离常数 |
| HF | Ki=3.5×10-4 |
| H2CO3 | Ki1=4.4×10-7 |
| Ki2=4.7×10-11 | |
| HClO | Ki=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO-<HCO3-<F- | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ |
分析 弱酸的电离平衡常数越大,酸性越强,弱酸的电离平衡常数越小,酸性越弱,其酸根结合氢离子的能力越强,其对应的盐水解程度越大,强酸可以制弱酸.
解答 解:据表格分析,酸性由强到弱的顺序为:HF、H2CO3、HClO,
A、酸性由强到弱的顺序为:HF、H2CO3、HClO,酸性越弱,其酸根结合氢离子的能力越强,溶液pH:Na2CO3>NaClO>NaF,故A错误;
B、酸性由强到弱的顺序为:HF、H2CO3、HClO,结合H+ 的能力:CO32->ClO->F-,故B错误;
C、碳酸的第一步电离酸性比次氯酸强,可以发生反应,ClO-+CO2+H2O=HCO3-+HClO,故C正确;
D、碳酸钠溶液中加入少量氢氟酸时,先生成碳酸氢根离子,离子方程式为:CO32-+HF=F-+HCO3-,故D错误;
故选C.
点评 本题考查了据弱酸的电离平衡常数判断酸性强弱及强酸制弱酸,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
20.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
7.“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献.制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全.试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如右表,单位:g/100g水).
(1)117g食盐理论上可以制取纯碱106 g;
(2)45℃反应完毕后,有晶体析出,计算析出晶体的质量.
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量.
| NaCl | NaHCO3 | NH4Cl | |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
(1)117g食盐理论上可以制取纯碱106 g;
(2)45℃反应完毕后,有晶体析出,计算析出晶体的质量.
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量.
17.某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏,则该物质固态时属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
4.25℃时,纯水的电离度为α1,pH=11的氨水中水的电离度为α2;pH=3的盐酸中水的电离度为α3;若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为α4,下列关系正确的( )
| A. | α1<α2<α3<α4 | B. | α3<α2<α1<α4 | C. | α2=α3<α4<α1 | D. | α2=α3<α1<α4 |
9.利用铜萃取剂M,通过如下反应实现铜离子的富集(如图1):
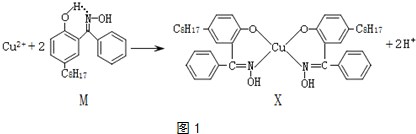
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图2)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
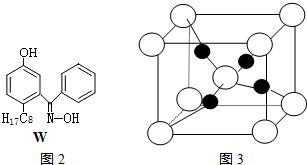
(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表.回答下列问题:
图3是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是4.

(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图2)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.

(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表.回答下列问题:
| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
①该温度是1000℃以上.
②铜原子的配位数是4.
 ;
;