题目内容
15.下列化学用语正确的( )| A. | I-131:${\;}_{53}^{77}$I | B. | Cl-的结构示意图: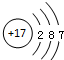 | ||
| C. | 乙炔的结构简式:CHCH | D. | Na2S的电子式: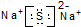 |
分析 A.元素符号的左上角为质量数、左下角为质子数;
B.氯离子的核外电子总数为18,最外层达到8电子稳定结构;
C.乙炔分子中含有碳碳三键,结构简式中不能省略;
D.硫化钠为离子化合物,钠离子直接用离子符号表示,阴离子需要标出所带电荷及最外层电子.
解答 解:A.I-131的质子数为53,质量数为131,该原子的正确表示方法为:53131I,故A错误;
B. 为氯原子结构示意图,氯离子的最外层满足8电子稳定结构,正确的离子结构示意图:
为氯原子结构示意图,氯离子的最外层满足8电子稳定结构,正确的离子结构示意图: ,故B错误;
,故B错误;
C.乙炔分子中含有1个碳碳三键,其正确的结构简式为:CH≡CH,故C错误;
D.Na2S为化合物,阴阳离子需要标出所带电荷,硫离子还需要标出最外层电子,硫化钠的电子式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、元素符号、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
5.利用下列实验装置不能完成相应实验的是( )
| A. | 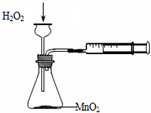 定量测定化学反应速率 | B. | 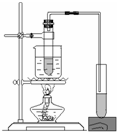 实验室制乙酸丁酯 | ||
| C. | 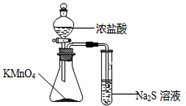 比较KMnO4、Cl2、S的氧化性 | D. | 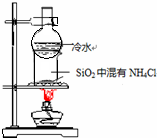 分离SiO2和NH4Cl |
20.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
7.“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献.制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全.试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如右表,单位:g/100g水).
(1)117g食盐理论上可以制取纯碱106 g;
(2)45℃反应完毕后,有晶体析出,计算析出晶体的质量.
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量.
| NaCl | NaHCO3 | NH4Cl | |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
(1)117g食盐理论上可以制取纯碱106 g;
(2)45℃反应完毕后,有晶体析出,计算析出晶体的质量.
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量.
4.25℃时,纯水的电离度为α1,pH=11的氨水中水的电离度为α2;pH=3的盐酸中水的电离度为α3;若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为α4,下列关系正确的( )
| A. | α1<α2<α3<α4 | B. | α3<α2<α1<α4 | C. | α2=α3<α4<α1 | D. | α2=α3<α1<α4 |
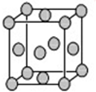 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题. .填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).
.填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).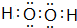 ,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.
,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.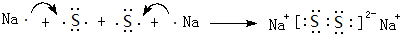 .
.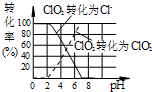 作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处