题目内容
10. 铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.
铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.请回答下列问题:
(1)其中一项实验记录如下:
根据图分析,温度不是(填“是”或“不是”)影响该反应速率的主要因素,理由是温度不是反应速率明显加快的主要原因.
(1)在两只试管中分别盛有等量稀硝酸,再分别放入大小、形状均完全相同且等质量的纯铜片.向其中一只试管中加入少量Cu(NO3)晶体,发现两只试管中的现象基本相同.该实验表明,Cu2+的浓度不是(填“是”或“不是”)影响该反应速率的主要因素.
(3)查阅文献,得到如下信息:“稀硫酸的氧化作用可以人为首先被还原为NO2…硝酸通过NO2获得还原剂的电子生成NO2-,反应便被加速…“NO2-或NO2都是该反应的催化剂.
①为证明NO2-也是该反应的催化剂,甲同学设计如下实验:在铜与稀硝酸的反应 体系中加入少量KNO2晶体,观察反应速率的变化.但乙同学指出,即使观察到明显变化也不能表明NO2-反应有催化作用,请指出乙同学的理由:未排除K+对该反应有无催化作用.
②某同学设计如下实验来验证NO2,是该反应的催化剂:在规格相同的试管A、B 中均加入等体积等浓度的稀硝酸,再分别加入质量完全相同的铜片和铜粉.向B试管中通入NO2气体,发现B试管中的反应速率明显比A试管的反应速率快.该同学的实验设计不合理,请指出改进措施:两支试管中均使用质量相同的铜粉.
分析 (1)验证温度对速率的影响,获得实验数据后可以获得一系列结论,如果把它放在整个实验探究中去理解可知最重要的结论是反应液温度上升不是反应速率明显加快的主要原因;
(2)加入少量Cu(NO3)晶体,即Cu2+的浓度增加,但实验发现两只试管中的现象基本相同,故Cu2+的浓度不是影响该反应速率的主要因素;
(3)①据未排除K+对该反应有无催化作用来分析;
②探究性实验务必要做到控制变量来分析.
解答 解:(1)由图象可知,随着反应的进行,反应速率明显加快,但温度变化不大,所以温度不是反应速率明显加快的主要原因;
故答案为:不是;温度不是反应速率明显加快的主要原因;
(2)加入少量Cu(NO3)晶体,即Cu2+的浓度增加,但实验发现两只试管中的现象基本相同,故Cu2+的浓度不是影响该反应速率的主要因素,
故答案为:不是;
(3)①在铜与稀硝酸的反应体系中加入少量KNO2晶体,引入了K+,也可能是K+对该反应有催化作用,不一定是NO2-对该反应有催化作用,故乙同学的理由是未排除K+对该反应有无催化作用,
故答案为:未排除K+对该反应有无催化作用;
②研究NO2是该反应的催化剂,故要控制其它条件相同,则两支试管中均使用质量相同的铜粉,故该同学的实验设计不合理,改进措施是两支试管中均使用质量相同的铜粉,
故答案为:两支试管中均使用质量相同的铜粉.
点评 本题考查了铜和硝酸的反应实验,设计实验是高考的热点,也是学习的难点,本题较为简单.

练习册系列答案
相关题目
5.某元素原子最外层只有1个电子,它与卤素相结合时,所形成的化学键( )
| A. | 一定是共价键 | B. | 一定是离子健 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 既含离子键又含共价键 |
6.能用H++OH-=H2O表示的是( )
| A. | NH3•H2O+HNO3→NH4NO3+H2O | B. | CH3COOH+KOH→CH3COOK+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | 2HCl+Ca(OH)2→CaCl2+2H2O |
3.下列有关元素的性质及其递变规律正确的是( )
| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |
5.下列有关说法正确的是( )
| A. | 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| C. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2] | |
| D. | 已知I${\;}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
15.溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,能完整表示该反应的离子方程式是( )
| A. | CO32-+Ba2+=BaCO3 | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-→H2O+BaCO3 | |
| D. | 2HCO3-+Ba2++OH-=BaCO3+2H2O+CO32- |
19.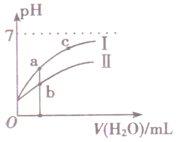 如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 等浓度等体积的CH3COONa和NaClO两种溶液中,阴离子的总物质的量前者小于后者 | |
| C. | 图中a、b两点对应的酸的物质的量浓度a>b | |
| D. | 图中a、c两点的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) |
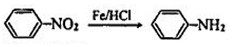 (苯环上的-NH2易被氧化).
(苯环上的-NH2易被氧化).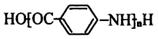 .
.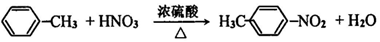 .
. .
. .
.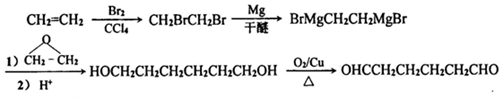 .
.