题目内容
18.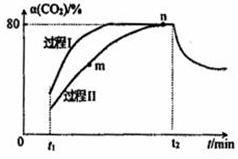 一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )| A. | m点:v(正)>v(逆) | |
| B. | 活化能:过程Ⅱ>过程I | |
| C. | n点时该反应的平衡常数K=50 | |
| D. | 过程I,t2时刻改变的反应条件可能是升高温度 |
分析 A.根据图象,随着反应时间(t)的延长,m点后α(CO2)仍然在增大,说明仍然向正反应方向移动;
B.根据图象,相同时间内过程I的α(CO2)比过程Ⅱ大,说明过程I反应速率快;
C.由图可知,N点对应的α(CO2)为80%,据此列三段式结合平衡常数K的计算公式进行计算;
D.由图可知,t2时刻后α(CO2)减小,则平衡向逆向移动.
解答 解:A.根据图象,随着反应时间(t)的延长,m点后α(CO2)仍然在增大,说明仍然向正反应方向移动,则m点:v(正)>v(逆),故A正确;
B.根据图象,相同时间内过程I的α(CO2)比过程Ⅱ大,说明过程I反应速率快,所以过程I活化能小,则活化能:过程Ⅱ>过程I,故B正确;
C.由图可知,N点对应的α(CO2)为80%,则
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 2.8 0 0
反应 0.8 2.4 0.8 0.8
平衡 0.2 0.4 0.8 0.8
又体积为2.0L,所以K=$\frac{\frac{0.8}{2}×\frac{0.8}{2}}{\frac{0.2}{2}×(\frac{0.4}{2}){\;}^{3}}$=200,故C错误;
D.由图可知,t2时刻后α(CO2)减小,则平衡向逆向移动,又该反应为放热反应,所以可能是升高温度,故D正确;
故选C.
点评 本题考查转化率随时间变化曲线、化学平衡影响因素与平衡常数计算等,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
8.香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示.下列有关香天竺葵醇的说法错误的是( )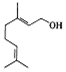

| A. | 分子中含有两种官能团 | |
| B. | lmol该物质与lmolHBr发生加成反应的产物共有5种(不考虑立体异构) | |
| C. | 使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同 | |
| D. | 香天竺葵醇能发生加聚反应和氧化反应 |
9.某有机物X的结构简式如图所示,则下列说法正确的是( )
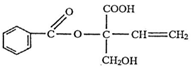

| A. | X的分子式为C12H14O5 | |
| B. | 1molX最多消耗1molNaOH | |
| C. | X在一定条件下能发生取代、加成、加聚、氧化等反应 | |
| D. | X苯环上的二氯代物有7种(不考虑立体异构) |
6.能用H++OH-=H2O表示的是( )
| A. | NH3•H2O+HNO3→NH4NO3+H2O | B. | CH3COOH+KOH→CH3COOK+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | 2HCl+Ca(OH)2→CaCl2+2H2O |
13.下列化学药品的保存方法合理的是( )
| A. | 金属钾保存在乙醇中 | |
| B. | 常温下浓硫酸可存放在铁质容器中 | |
| C. | NaOH溶液保存在玻璃塞的试剂瓶中 | |
| D. | FeCl3溶液中加入少量还原铁粉存放 |
3.下列有关元素的性质及其递变规律正确的是( )
| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |
5.下列有关说法正确的是( )
| A. | 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| C. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2] | |
| D. | 已知I${\;}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
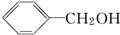 ,B
,B .
. .
.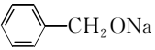 +H2↑.
+H2↑.