题目内容
下表是某地市场上销售的一种“加碘食盐”包装袋上的部分文字说明.
(1)加碘盐不能长时间炖炒,且应避热、避光保存,你认为可能的原因是什么?
(2)实验分析发现,某批加碘盐中KIO3的含量为52mg.kg-1.试计算每千克加碘盐中KIO3的物质的量和碘的质量.
(3)若成人每天需摄入0.15~0.20mg碘才能满足人体健康的需要,试通过计算说明成人每天食用6.0g这种加碘盐是否能获得所需要的碘.
| 配料 | 氯化钠(NaCl)、碘酸钾(KlO3) |
| 含碘量 | 20-40mg.kg-1 |
| 保质期 | 18个月 |
| 使用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
(2)实验分析发现,某批加碘盐中KIO3的含量为52mg.kg-1.试计算每千克加碘盐中KIO3的物质的量和碘的质量.
(3)若成人每天需摄入0.15~0.20mg碘才能满足人体健康的需要,试通过计算说明成人每天食用6.0g这种加碘盐是否能获得所需要的碘.
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:(1)根据加碘盐中的碘酸钾受热易分解;
(2)公式m=nM结合原子守恒来计算;
(3)根据加碘盐中KIO3的含量为52mg.kg-1,计算6.0g这种加碘盐中碘元素的含量,比较即可.
(2)公式m=nM结合原子守恒来计算;
(3)根据加碘盐中KIO3的含量为52mg.kg-1,计算6.0g这种加碘盐中碘元素的含量,比较即可.
解答:
解:(1)碘酸钾受热见光易分解,所以加碘盐不能长时间炖炒,且应避热、避光保存,答:碘酸钾受热见光易分解;
(2)加碘盐中KIO3的含量为52mg.kg-1,每千克加碘盐中KIO3的物质的量n=
=
=2.43×10-4 mol,碘的质量m=nM=2.43×10-4 mol×127g/mol=0.031g,答:每千克加碘盐中KIO3的物质的量是2.43×10-4 mol,碘的质量是0.031g;
(3)每天食用6.0g这种加碘盐,含有碘酸钾的质量是
=0.312mg,含有碘元素的质量是:0.312mg×
×100%=0.185mg,界于0.15~0.20mg范围内,所以可以满足人体需要,答:成人每天食用6.0g这种加碘盐能获得所需要的碘.
(2)加碘盐中KIO3的含量为52mg.kg-1,每千克加碘盐中KIO3的物质的量n=
| m |
| M |
| 0.052g |
| 214g/mol |
(3)每天食用6.0g这种加碘盐,含有碘酸钾的质量是
| 0.006kg×52mg |
| 1kg |
| 127 |
| 214 |
点评:本题考查学生利用信息中物质的化学式进行简单计算,学生应注重与所学知识的结合来解答,本题还注重了化学与生活的联系,可让学生认识生活中的化学知识,加强学习兴趣的引导.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
A、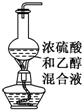 实验室制乙烯 |
B、 实验室制乙炔并验证其还原性 |
C、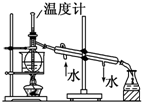 实验室中分馏石油 |
D、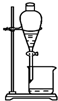 分离水和苯的混合物 |
不饱和脂肪酸是常见的保健品,DHA(分子式为C22H32O2)是近年来倍受关注的一元不饱和高级脂肪酸(分子中只含有双键),它对大脑细胞的生长发育具有重要意义,许多海洋生物食品含有丰富的DHA.则在一个DHA分子中含有的碳碳双键数为( )
| A、4个 | B、5个 | C、6个 | D、7个 |
下列说法不正确的是( )
| A、光催化还原水制氢比电解水制氢更节能环保、更经济 |
| B、氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 |
| C、某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能检测细胞内浓度约为10-12-10-11mol?L-1的目标分子 |
| D、向汽油中添加甲醇后,该混合燃料的热值不变 |
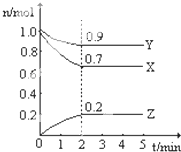 I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: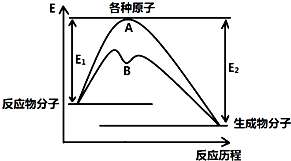 已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题: