题目内容
3.北京奥运会火炬使用的燃料是一种有机物,其分子式为C3H8,它属于( )| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
分析 烷烃的结构特点为:碳原子之间以单键结合成链状(直链或含支链)外,其余化合价全部为氢原子所饱和,通式为CnH2n+2;
烯烃的结构特点为:含有1个C=C双键,其余化学键为单键,为链烃,通式为CnH2n;
炔烃的结构特点为:含有1个C≡C,其余化学键为单键,为链烃,通式为CnH2n-2;
芳香烃为含有苯环的烃;
解答 解:A.丙烷的化学式为C3H8,分子中碳原子之间形成单键,其余价键为H原子饱和,为链烃,分子中不含双键、三键、苯环,故丙烷属于烷烃,符合通式CnH2n+2,故A正确;
B.烯烃通式为CnH2n,C3H8不符合,故B错误;
C.炔烃通式为CnH2n-2,C3H8不符合,故C错误;
D.芳香烃需要含苯环,C3H8不符合,故D错误;
故选A.
点评 本题考查烃的分类,比较基础,注意掌握各类的结构特点以及通式是解题的关键,题目难度不大.

练习册系列答案
相关题目
1.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 钢铁制品和铜制品均既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
2.下列说法正确的是( )
| A. | 一定量(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH${\;}_{4}^{+}$)>2c(SO${\;}_{4}^{2-}$) | |
| B. | 向25mL0.1mol/L的溶液①氨水 ②NH4Cl溶液分别加入25mL0.1mol/L盐酸后,溶液中c(NH${\;}_{4}^{+}$):①>② | |
| C. | 将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol/L的KHA溶液,其pH=10:c(K+)>c(A2-)>c(HA-)>c(OH-) |
18.下列说法正确的是( )
| A. | 植物油的主要成分是高级脂肪酸 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
8.下列说法中正确的是( )
①油脂在酸性或碱性条件下均可发生水解反应,且产物相同
②由油脂得到甘油和由淀粉得到葡萄糖均发生了水解反应
③淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
④用新制的银氨溶液可区分甲酸甲酯和乙醛.
①油脂在酸性或碱性条件下均可发生水解反应,且产物相同
②由油脂得到甘油和由淀粉得到葡萄糖均发生了水解反应
③淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
④用新制的银氨溶液可区分甲酸甲酯和乙醛.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
15.下列叙述不正确的是( )
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 工业上电解饱和食盐水的阴极反应:2H++2e-═H2↑ |
12.锰的单质及其化合物在生产、生活中有广泛应用.
(1)碱性锌锰电池广泛应用于日常生活.电池的总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).
该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
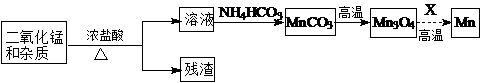
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
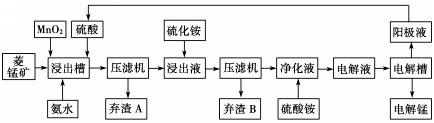
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
①浸出槽内MnO2的作用是(用离子方程式表示)MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O.
②加入氨水调节浸出槽中溶液的pH范围为3.8≤pH<8.3.
③电解槽阴极的电极反应式为Mn2++2e-=Mn.
(1)碱性锌锰电池广泛应用于日常生活.电池的总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).
该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
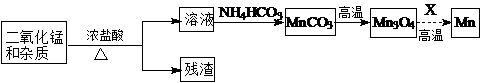
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:

已知:NiS、CoS均难溶于水.部分氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围为3.8≤pH<8.3.
③电解槽阴极的电极反应式为Mn2++2e-=Mn.
13.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | 标准状况下,22.4LO2所含的分子数为NA | |
| D. | 1L0.2mol/LKCl溶液中所含的K+为2NA |