题目内容
15.下列叙述不正确的是( )| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 工业上电解饱和食盐水的阴极反应:2H++2e-═H2↑ |
分析 A、氢氧燃烧电池是将化学能转化为电能;
B、在原电池中,较活泼的金属往往做负极,负极金属易被腐蚀;
C、钢铁腐蚀的负极反应:Fe-2e-═Fe2+;
D、电解池的阴极发生还原反应.
解答 解:A、氢氧燃烧电池是将化学能转化为电能,是原电池,故A正确;
B、在锌、铁原电池中,较活泼的金属锌往往做负极,负极金属易被腐蚀,正极金属可以被保护,故B正确;
C、钢铁腐蚀的负极反应:Fe-2e-═Fe2+,而不是生成铁离子,故C错误;
D、电解池的阴极发生还原反应,氢离子放电生成氢气,电极反应式为:2H++2e-═H2↑,故D正确;
故选C.
点评 本题考查学生原电池和电解池的工作原理以及应用知识,注意知识的积累是解题的关键,难度不大.

练习册系列答案
相关题目
13.下列实验的反应原理用方程式或电极反应式表示正确的是( )
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2═CO2+2H2O | |
| D. | 铅蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
6.下列各化合物的命名中正确的是( )
| A. | CH2=C(CH3)-CH=CH2 2-甲基-1,3-二丁烯 | |
| B. | 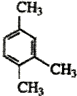 1,3,4-三甲苯 1,3,4-三甲苯 | |
| C. | CH3CH2C≡CCH2 CH (CH3)2 6-甲基-3-庚炔 | |
| D. | 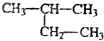 2-甲基丁烷 2-甲基丁烷 |
3.北京奥运会火炬使用的燃料是一种有机物,其分子式为C3H8,它属于( )
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
10. 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,A的电负性>B的电负性(填“>”、“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据如表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3杂化.
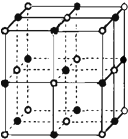
(3)实验证明:KCl、CaO这2种晶体的结构与NaCl晶体结构相似(如图所示):
则KCl、CaO这2种晶体熔点从高到低的顺序是:CaO>KCl,其原因是离子半径越小,离子所带电荷越多,晶格能越大,熔点越高 (从影响晶格能大小的因素进行描述).其中CaO晶体中一个Ca2+周围和它最邻近且等距离的Ca2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据如表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3杂化.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
则KCl、CaO这2种晶体熔点从高到低的顺序是:CaO>KCl,其原因是离子半径越小,离子所带电荷越多,晶格能越大,熔点越高 (从影响晶格能大小的因素进行描述).其中CaO晶体中一个Ca2+周围和它最邻近且等距离的Ca2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
20.某天然油脂的分子式为C57H106O6.1mol该油脂水解可得到1mol甘油、1mol脂肪酸X和2mol直链饱和脂肪酸Y;经测定X的相对分子质量为280,原子个数比为C:H:O=9:16:1.下列说法错误的是( )
| A. | X的分子式为C18H32O2 | |
| B. | 脂肪酸Y能发生取代反应 | |
| C. | Y的结构简式可能为CH3CH=CH(CH2)14COOH | |
| D. | Y的结构简式为CH3(CH2)16COOH |
7.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 0.5mol/L 的AlCl3溶液中含有的Al3+数为0.5 NA | |
| C. | 常温常压下16g O2中,氧原子数为NA | |
| D. | 1mol过氧化钠与水充分反应,转移的电子数为2NA |
4.甲~辛等元素在周期表中的位置如表所示.下列说法不正确的是( )
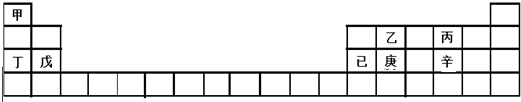

| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
5.PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将l mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2.则剩余固体的组成及物质的量比是( )
| A. | 1:1混合的Pb3O4、PbO | B. | 1:2混合的PbO2、Pb3O4 | ||
| C. | 1:4:l混合的PbO2、Pb3O4、PbO | D. | 1:1:l 混合的PbO2、Pb3O4、PbO |