题目内容
1.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 钢铁制品和铜制品均既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
分析 A.氯碱工业制备氢氧化钠,应用阳离子交换膜;
B.铜与氢离子不反应,不能发生析氢腐蚀;
C.氢键属于分子间作用力;
D.开发氢能、太阳能、风能、生物质能等可减少化石能源的使用.
解答 解:A.氯碱工业在阴极生成氢氧化钠,钠离子向阴极移动,应采用的是阳离子交换膜,故A错误;
B.钢铁制品既能发生吸氧腐蚀,又能发生析氢腐蚀,但由于铜不能与H+反应,故铜制品只能发生吸氧腐蚀,但不能发生析氢腐蚀,故B错误;
C.氢键不是化学键.是一种特殊的分子间的作用力,故C错误.
D.开发氢能、太阳能、风能、生物质能等可减少化石能源的使用,可是实现“低碳生活”的有效途径,故D正确.
故选D.
点评 本题考查较为综合,涉及氯碱工业、金属的腐蚀、氢键以及能源等知识,侧重于化学与生活、生产以及环境保护的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
11.对于化学反应3W(g)+2X(g)═4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
| A. | υ(W)=3υ(Z) | B. | 3υ(X)=2υ(Z) | C. | υ(X)=2υ(Y) | D. | 3υ(W)=2υ(X) |
12.下列变化属于物理变化的是( )
| A. | 硫酸铜晶体失水 | B. | 石油分馏 | C. | 石油裂解 | D. | 煤的干馏 |
9.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,且有良好的超导性,下列K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性共价键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式可定成KC20 | |
| D. | C60与12C互为同素异形体 |
16.下列叙述中正确的是( )
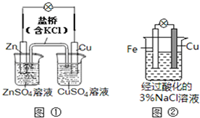

| A. | 图①中正极附近溶液pH降低 | |
| B. | 图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 | |
| C. | 图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 | |
| D. | 图②正极反应是O2+2H2O+4e-═4OH- |
6.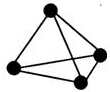 在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )
在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )
 在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )
在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅥA | B. | ⅢA | C. | ⅤA | D. | ⅣA |
13.下列实验的反应原理用方程式或电极反应式表示正确的是( )
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2═CO2+2H2O | |
| D. | 铅蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
10.已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 1.0 mol•L-1 | D. | 1.2 mol•L-1 |
3.北京奥运会火炬使用的燃料是一种有机物,其分子式为C3H8,它属于( )
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |