题目内容
13.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | 标准状况下,22.4LO2所含的分子数为NA | |
| D. | 1L0.2mol/LKCl溶液中所含的K+为2NA |
分析 A、氮气为双原子分子;
B、标况下水为液体;
C、分子个数N=$\frac{V}{Vm}{N}_{A}$;
D、求出KCl的物质的量,然后根据1molKCl中含1mol钾离子来分析.
解答 解:A、氮气为双原子分子,故1mol氮气中含2mol氮原子即2NA个,故A错误;
B、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故B错误;
C、标况下22.4L氧气中含有的分子个数N=$\frac{V}{Vm}{N}_{A}$=$\frac{22.4L}{22.4L/mol}×{N}_{A}/mol$=NA个,故C正确;
D、溶液中KCl的物质的量n=CV=0.2mol/L×1L=0.2mol,而1molKCl中含1mol钾离子,故0.2molKCl中含0.2NA个钾离子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.北京奥运会火炬使用的燃料是一种有机物,其分子式为C3H8,它属于( )
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
4.甲~辛等元素在周期表中的位置如表所示.下列说法不正确的是( )
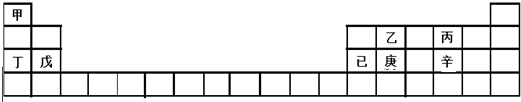

| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
1.下列关于药物的说法正确的是( )
| A. | 药物的服用剂量越大,治疗效果越明显 | |
| B. | 包装上印有“OTC“标志的药品属于处方药 | |
| C. | 氢氧化铝可作为抑酸剂,用于治疗胃酸过多 | |
| D. | 长期大量服用阿司匹林可预防某些疾病,没有副作用 |
8.下列金属单质,活泼性最强的是( )
| A. | Na | B. | Mg | C. | Al | D. | Fe |
18.下列溶液中一定能大量共存的离子组是( )
| A. | Mg2+、Na+、Cl-、NO3- | B. | K+、H+、NO3-、HCO3- | ||
| C. | Ba2+、K+、OH-、SO42- | D. | OH-、Al3+、Ag+、NO3- |
5.PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将l mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2.则剩余固体的组成及物质的量比是( )
| A. | 1:1混合的Pb3O4、PbO | B. | 1:2混合的PbO2、Pb3O4 | ||
| C. | 1:4:l混合的PbO2、Pb3O4、PbO | D. | 1:1:l 混合的PbO2、Pb3O4、PbO |
2.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀醋酸中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
3.能产生“丁达尔效应”的是( )
| A. | 泥水 | B. | 淀粉溶液 | C. | 氯化铁溶液 | D. | 稀硫酸 |