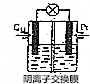
题目内容
2.下列说法正确的是( )| A. | 一定量(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH${\;}_{4}^{+}$)>2c(SO${\;}_{4}^{2-}$) | |
| B. | 向25mL0.1mol/L的溶液①氨水 ②NH4Cl溶液分别加入25mL0.1mol/L盐酸后,溶液中c(NH${\;}_{4}^{+}$):①>② | |
| C. | 将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol/L的KHA溶液,其pH=10:c(K+)>c(A2-)>c(HA-)>c(OH-) |
分析 A.溶液中存在电荷守恒,溶液中阴阳离子所带电荷总数相同;
B.盐酸和一水合氨恰好反应生成氯化铵溶液,在氯化铵溶液中抑制铵根离子的水解;
C.将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合得到等浓度的CH3COOH溶液和CH3COONa溶液的混合溶液,依据电荷守恒和物料守恒分析判断离子浓度关系;
D.0.1mol/L的KHA溶液,其pH=10溶液显碱性,HA-离子水解大于其电离.
解答 解:A.一定量(NH4)2SO4与NH3•H2O混合所得的酸性溶液中,c(H+)>c(OH-),电荷守恒:c(H+)+c(NH的4+)=c(OH-)+2c(SO42-),c(NH4+)<2c(SO42-),故A错误;
B.盐酸和一水合氨恰好反应生成氯化铵溶液,氯化铵的浓度为0.05mol/L,氯化铵溶液中加入盐酸抑制铵根离子的水解,溶液中c(NH4+):①<②,故B错误;
C.将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合得到等浓度的CH3COOH溶液和CH3COONa溶液的混合溶液,溶液中存在电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),物料守恒2c(Na+)=c(CH3COO-)+c(CH3COOH),代入计算得到2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH),故C正确;
D.0.1mol/L的KHA溶液,其pH=10溶液显碱性,HA-离子水解大于其电离,c(K+)>c(HA-)>c(OH-)>c(A2-),故D错误;
故选C.
点评 本题考查了弱电解质电离平衡,盐类水解的应用、溶液酸碱性的分析判断,溶液电荷守恒、物料守恒等知识点,掌握基础是解题关键,题目难度中等.

| A. | 硫酸铜晶体失水 | B. | 石油分馏 | C. | 石油裂解 | D. | 煤的干馏 |
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2═CO2+2H2O | |
| D. | 铅蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 1.0 mol•L-1 | D. | 1.2 mol•L-1 |
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 无法确定 |
| A. | CH2=C(CH3)-CH=CH2 2-甲基-1,3-二丁烯 | |
| B. | 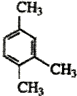 1,3,4-三甲苯 1,3,4-三甲苯 | |
| C. | CH3CH2C≡CCH2 CH (CH3)2 6-甲基-3-庚炔 | |
| D. | 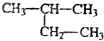 2-甲基丁烷 2-甲基丁烷 |
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
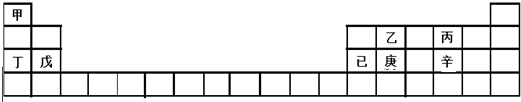
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |