题目内容
15.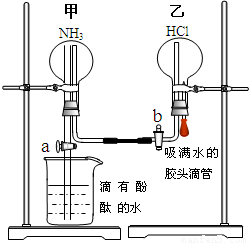 某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:(Ⅰ)NH3的制取及收集
(1)写出实验制取氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
(2)收集氨气
(Ⅱ)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
(1)实验室制取HCl气体可选择下列装置中的
A.实验室制氧气的装置
B.实验室制氢气的装置
C.实验室制二氧化碳的装置
D.实验室制氯气的装置
(2)实验室制取HCl气体的反应原理遵循了以下化学反应规律中的CD
A.氧化还原反应原理
B.强酸制弱酸原理
C.难挥发性酸制取易挥发性酸
D.复分解反应原理
(Ⅲ)验证氨气部分性质的探究实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们设计了如下的实验装置图.首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
(1)先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是:产生大量的白烟.
发生反应的方程式为:NH3+HCl=NH4Cl.
(2)待乙中观察到明显现象后立即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是:甲中有喷泉,溶液变红..
分析 (Ⅰ)(1)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水;
(Ⅱ)(1)依据反应物状态和反应条件选择发生装置;
(2)依据方程式2NaCl(晶体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑类型结合浓硫酸、浓盐酸性质解答;
(Ⅲ)(1)依据氨气与氯化氢反应生成白色固体氯化铵解答;
(2)依据氨气与氯化氢反应,气体减少,瓶内气压减小,在外界大气压作用下水被压入烧瓶,而氨气极易溶于水,与水反应生成一水合氨,一水合氨电离生成氢氧根离子的性质解答.
解答 解:(Ⅰ)(1)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
(Ⅱ)(1)由方程式:2NaCl(晶体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑可知,制备氯化氢,反应为状态为固体与液体,反应条件为加热,
A.实验室制氧气的装置为固体固体加热,与制备氯化氢不同,故A不选;
B.实验室制氢气为固体与液体不加热,与制备氯化氢不同,故B不选;
C.实验室制二氧化碳的装置,为固体与液体不加热,与制备氯化氢不同,故C不选;
D.实验室制氯气的装置,为固体与液体加热,与制备氯化氢相同,故D选;
故选:D;
(2)2NaCl(晶体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑为复分解反应,浓硫酸难挥发,氯化氢易挥发,所以实验室制取HCl气体的反应原理遵循了:难挥发性酸制取易挥发性酸;复分解反应原理;
故选:CD;
(Ⅲ)(1)氨气与氯化氢反应生成白色固体氯化铵,方程式:NH3+HCl=NH4Cl,所以预测此时乙中可能观察到的现象是产生大量的白烟;
故答案为:产生大量的白烟;NH3+HCl=NH4Cl;
(2)氨气与氯化氢反应,气体减少,瓶内气压减小,在外界大气压作用下水被压入烧瓶,而氨气极易溶于水,与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶于显碱性,所以看到现象为:甲中有喷泉,溶液变红;
故答案为:甲中有喷泉,溶液变红.
点评 本题考查了氨气、氯化氢的实验室制备及性质,明确气体制备原理及发生装置选择依据是解题关键,题目难度不大.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| A. | 22.4LCO2与足量的 Na2O2反应时,转移的电子数为 NA 个 | |
| B. | 0.1mol 铁在 0.1molCl2 中充分燃烧,转移的电子数为 0.2NA 个 | |
| C. | 对于反应:A(g)+B(g)?C(g)+D(g)单位时间内生成 NA 个 A 分子时,同时消耗NA 个 C 分子,说明该反应一定达到最大限度 | |
| D. | Zn-H2SO4-Cu 原电池中,当电路中有 NA 个电子通过时,溶液的质量增加 1g |
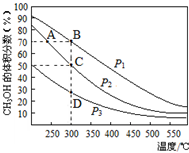 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )| A. | 该反应的△H<0,且p1<p2 | |
| B. | 反应速率:ν逆(状态A)>ν逆(状态B) | |
| C. | 在C点时,CO转化率为75% | |
| D. | 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同 |
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | C2H4、C3H6和  中均含有碳碳双键 中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
| A. | 向卤代烃水解后的溶液中加入AaNO3溶液,根据沉淀颜色可以判断卤素原子种类 | |
| B. | 银镜反应、乙酸乙酯的水解反应、苯的硝化反应均需水浴加热 | |
| C. | 甲酸酯、葡萄糖、麦芽糖均能发生银镜反应 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是为了得到更多的乙烯、丙烯等气态短链烃 |
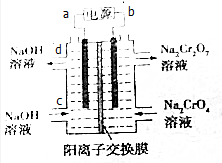 已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )
已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )| A. | CrO42-生成Cr2O72-的反应为非氧化还原反应,不能通过电解方法获得 | |
| B. | a为电源正极 | |
| C. | d口流出的NaOH溶液的浓度与c口通入的NaOH溶液的浓度相同 | |
| D. | Na+从右侧通过阳离子交换膜进入左侧 |
| A. | N2→NH3→NO→NO2→HNO3→NO | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
