题目内容
20.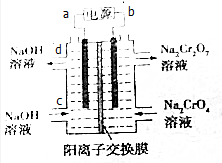 已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )
已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )| A. | CrO42-生成Cr2O72-的反应为非氧化还原反应,不能通过电解方法获得 | |
| B. | a为电源正极 | |
| C. | d口流出的NaOH溶液的浓度与c口通入的NaOH溶液的浓度相同 | |
| D. | Na+从右侧通过阳离子交换膜进入左侧 |
分析 已知反应:2CrO42-+2H+?Cr2O72-+H2O,电解时阳极氢氧根离子失电子,同时生成氢离子,氢离子浓度增大,化学平衡向右移动,CrO42-生成Cr2O72-,阴极上氢离子失电子生成氢气,同时生成氢氧根离子,据此分析.
解答 解:A.已知反应:2CrO42-+2H+?Cr2O72-+H2O,电解时阳极氢氧根离子失电子,同时生成氢离子,氢离子浓度增大,化学平衡向右移动,CrO42-生成Cr2O72-,所以通过电解方法获得,故A错误;
B.b相连的电极为阳极,则b为正极,所以a为负极,故B错误;
C.与a相连的电极为阴极,阴极上氢离子失电子生成氢气,同时生成氢氧根离子,则电解后溶液中氢氧根离子浓度增大,所以d口流出的NaOH溶液的浓度大于c口通入的NaOH溶液的浓度,故C错误;
D.阳离子向阴极移动,左侧为阴极,所以Na+从右侧通过阳离子交换膜进入左侧,故D正确.
故选D.
点评 本题考查了电解原理的应用和化学平衡移动,题目难度中等,侧重于考查学生的分析能力,注意把握电极的判断方法以离子在溶液中的移动方向.

练习册系列答案
相关题目
7.有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复).
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象.
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)用离子方程式表示A溶液pH大于7的原因:CH3COO-+H2O?CH3COOH+OH-.
(3)写出C和D反应的离子方程式Ba2++SO42-═BaSO4↓.
(4)25℃时,0.1mol•L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3•H2O)=10a-14mol•L-1(用含有a的关系式表示).
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)用离子方程式表示A溶液pH大于7的原因:CH3COO-+H2O?CH3COOH+OH-.
(3)写出C和D反应的离子方程式Ba2++SO42-═BaSO4↓.
(4)25℃时,0.1mol•L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3•H2O)=10a-14mol•L-1(用含有a的关系式表示).
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
8.下列各化合物中,能发生酯化、加成、消去三种反应的是( )
| A. | CH3-CH═CH-CHO | B. |  | ||
| C. | HOCH2-CH2-CH═CH-CHO | D. |  |
12.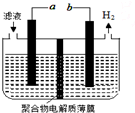 某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )
某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )
 某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )
某研究小组利用电化学方法处理石油炼制过程中产生的含H2S的废气.基本工艺是将H2S通入FeCl3溶液中,过滤后将滤液加入如图所示电解槽中电解,电解后的滤液可以循环利用.下列有关说法正确的是( )| A. | 过滤得到的沉淀可能是FeS | |
| B. | 与a极相连的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 可以用Fe与外接电源的a极相连 | |
| D. | 若有0.1mol电子发生转移,则一定能得到1.12LH2 |
9.为判断A、B、C、D四种金属单质的金属活动顺序,某实验小组做了如下实验:①测量A的硫酸盐溶液的pH,溶液的pH=7;②将B、C插入硫酸溶液中,C上无明显变化,用导线连接B、C,C电极上有气泡产生;③电解C、D的盐溶液首先析出单质D单质.下列组合中A、B、C、D可能是( )
| A. | Na、Mg、Cu、Ag | B. | K、Al、Zn、Fe | C. | Na、Zn、Fe、Cu | D. | Cu、Ag、Fe、Na |
10.下列事实中不能用平衡移动原理解释的是( )
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业生产中,使用过量空气以提高SO2的利用率 | |
| D. | 合成氨反应采用催化剂以提高氨气的生产效率 |
 .
.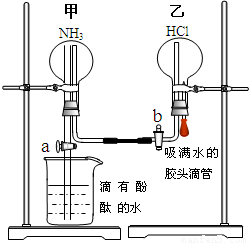 某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验: