题目内容
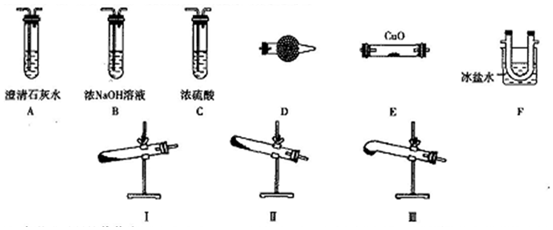
13.如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体.该装置可用于( )
| A. | 锌和盐酸生成氢气 | B. | 氯酸钾和二氧化锰生成氧气 | ||
| C. | 碳酸钙和盐酸生成二氧化碳 | D. | 氯化钠和浓硫酸生成氯化氢 |
分析 由制备实验装置可知,为固体与液体反应制备气体,且水可除去杂质,浓硫酸干燥气体,最后利用向下排空气法收集,以此来解答.
解答 解:A.生成氢气混有HCl,HCl极易溶于水,浓硫酸干燥氢气,最后向下排空气法收集氢气,故A选;
B.氧气的密度比空气密度大,应选向下排空气法收集,故B不选;
C.二氧化碳的密度比空气密度大,应选向下排空气法收集,故C不选;
D.生成HCl极易溶于水,不能选水除去杂质,且最后收集方法不合理,故D不选;
故选A.
点评 本题考查制备实验评价,为高频考点,把握实验装置的作用、实验技能、气体的制备原理为解答的关键,侧重分析与实验能力的考查,注意气体的性质,题目难度不大.

练习册系列答案
相关题目
3.下列有关溶液组成的描述合理的是( )
| A. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
1.某品牌茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.图是该实验可能用到的实验用品.有关该实验的说法中错误的是( )


| A. | 第一步需选用仪器①、②和⑨,仪器①的名称叫坩埚 | |
| B. | 第二步用浓硝酸溶解茶叶灰,可能将Fe2+氧化成Fe3+ | |
| C. | 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 | |
| D. | 第四步,用试剂⑧检验滤液中的Fe3+,溶液中生成血红色沉淀 |
8.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成酸性水溶液,然后按如图步骤进行提纯:
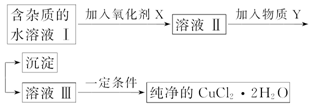
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.
18.同温同压下,同物质的量的CH4气体与CO体积比是( )
| A. | 3:1 | B. | 1:1 | C. | 1:3 | D. | 2:3 |
2.物质的量为0.10mol的镁条在足量的、且只含有CO2和O2混合气体的容器中充分燃烧(产物不含碳酸镁),反应后容器内固体物质的质量可能( )
| A. | 2.2g | B. | 4.2g | C. | 4.4g | D. | 4.8g |