题目内容
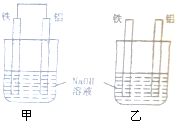 将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.
将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.| A、两烧杯中铝片表面均有气泡产生 |
| B、甲中铝片是正极,乙中铁片是负极 |
| C、两烧杯中溶液的pH均增大 |
| D、产生气泡的速度甲比乙快 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲中形成铁、铝原电池,铝作负极,失电子,铁作正极,H+在铁极上得电子,生成H2,总反应式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.乙装置中只是铝片与溶液发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,以此解答该题.
解答:
解:A.甲中形成铁、铝原电池,铝作负极,被氧化生成NaAlO2,没有气体生成,故A错误;
B.铝比铁活泼,且铝与氢氧化钠溶液反应,而铁不反应,甲中铝为负极,故B错误;
C.总反应均为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,消耗氢氧化钠,两烧杯中溶液的pH均减小,故C错误;
D.原电池反应较快,故D正确.
故选D.
B.铝比铁活泼,且铝与氢氧化钠溶液反应,而铁不反应,甲中铝为负极,故B错误;
C.总反应均为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,消耗氢氧化钠,两烧杯中溶液的pH均减小,故C错误;
D.原电池反应较快,故D正确.
故选D.
点评:本题考查了置换反应和原电池的有关知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握原电池的组成条件的工作原理.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
向50mL 18mol/L H2SO4溶液中加入足量的锌粒(可加热)充分反应后生成的气体的物质的量为( )
| A、小于0.45mol |
| B、等于0.45mol |
| C、在0.45mol和0.90mol之间 |
| D、等于0.90mol |
有机物E的名称是( )
| A、丁烷 | B、异丁烷 |
| C、异丁烯 | D、丁烯 |
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液得到9克沉淀,对样品所含杂质的正确判断是( )
| A、肯定没有KNO3 |
| B、肯定没有Ba(NO3)2和KNO3 |
| C、肯定没有Ba(NO3)2,可能有Na2CO3 |
| D、肯定没有Ba(NO3)2,可能有KNO3 |

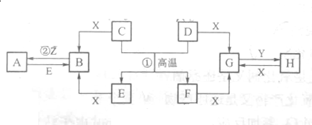 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).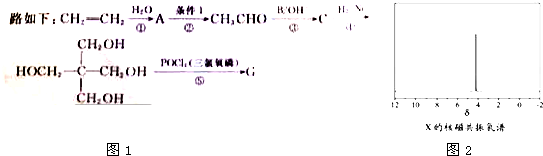
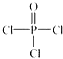 )与
)与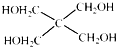 以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.
以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.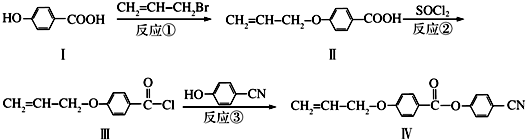
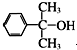 也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是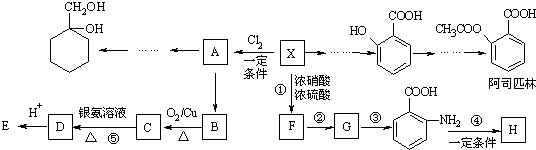
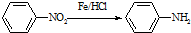 (苯胺,易被氧化)
(苯胺,易被氧化)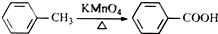
 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有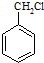 和其他无机物合成
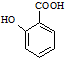
和其他无机物合成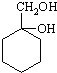 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例: