题目内容
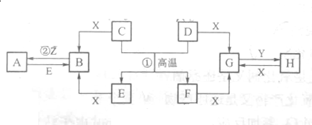 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).请回答下列问题:
(1)H的化学式为
(2)Y的电子式为
(3)写出反应②的离子方程式:
(4)写出反应①的化学方程式,并用单线桥标出电子转移的方向和数目:
考点:无机物的推断
专题:推断题
分析:D为既能与强酸反应,又能与强碱反应的单质,应为Al,则反应①为铝热反应,F应为Al2O3,潮湿的Z有漂白性,应为Cl2,由E→B→A的反应可知E为变价金属,应为Fe,则C为铁的氧化物,X应为非氧化性酸,由转化关系可知B含有Fe2+,则C为FeO,B为FeCl2,C为FeCl3,X为HCl,Y的焰色反应显黄色,说明含有钠元素,由G与H的反应可知G为AlCl3,Y为NaOH,H为NaAlO2,结合对应物质的性质以及题目要求可解答该题.
解答:
解:D为既能与强酸反应,又能与强碱反应的单质,应为Al,则反应①为铝热反应,F应为Al2O3,潮湿的Z有漂白性,应为Cl2,由E→B→A的反应可知E为变价金属,应为Fe,则C为铁的氧化物,X应为非氧化性酸,由转化关系可知B含有Fe2+,则C为FeO,B为FeCl2,C为FeCl3,X为HCl,Y的焰色反应显黄色,说明含有钠元素,由G与H的反应可知G为AlCl3,Y为NaOH,H为NaAlO2,
(1)由以上分析可知H为NaAlO2,故答案为:NaAlO2;
(2)Y为NaOH,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(3)反应②FeCl2为与氯气的反应,生成FeCl3,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)反应①为铝热反应,方程式为3FeO+2Al
3Fe+Al2O3,反应中Fe元素化合价降低,被还原,Fe2O3为氧化剂,Al元素化合价升高,被氧化,为还原剂,则Fe得到3×2e-,Al失去2×3e-,氧化产物为Al2O3,电子转移数目和方向可表示为 ,故答案为:
,故答案为: .
.
(1)由以上分析可知H为NaAlO2,故答案为:NaAlO2;
(2)Y为NaOH,为离子化合物,电子式为
 ,故答案为:
,故答案为: ;
;(3)反应②FeCl2为与氯气的反应,生成FeCl3,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)反应①为铝热反应,方程式为3FeO+2Al
| ||
 ,故答案为:
,故答案为: .
.
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,题目涉及铁、铝元素化合物性质与相互转化,难度中等,注意把握物质的特性,为解答该题的突破口.

练习册系列答案
相关题目
标准状况下2.24LCO气体在足量氧气中燃烧后,加足量的过氧化钠充分吸收气体后,过氧化钠质量增加了( )
| A、2.8g | B、4.4g |
| C、10.6g | D、1.4g |
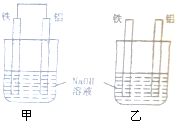 将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.
将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.| A、两烧杯中铝片表面均有气泡产生 |
| B、甲中铝片是正极,乙中铁片是负极 |
| C、两烧杯中溶液的pH均增大 |
| D、产生气泡的速度甲比乙快 |
反应A(g)+3B(g)═2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45mol/(L?s) ②v(B)=0.6mol/(L?s)
③v(C)=0.4mol/(L?s) ④v(D)=0.45mol/(L?s)
下列有关反应速率的比较中正确的是( )
①v(A)=0.45mol/(L?s) ②v(B)=0.6mol/(L?s)
③v(C)=0.4mol/(L?s) ④v(D)=0.45mol/(L?s)
下列有关反应速率的比较中正确的是( )
| A、④>③=②>① |
| B、④<③=②<① |
| C、①>②>③>④ |
| D、④>③>②>① |
 某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:
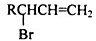
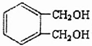 的同分异构体中同时符合下列条件的芳香族化合物共有
的同分异构体中同时符合下列条件的芳香族化合物共有
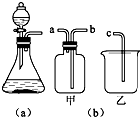 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和