题目内容
向50mL 18mol/L H2SO4溶液中加入足量的锌粒(可加热)充分反应后生成的气体的物质的量为( )
| A、小于0.45mol |
| B、等于0.45mol |
| C、在0.45mol和0.90mol之间 |
| D、等于0.90mol |
考点:化学方程式的有关计算
专题:
分析:开始发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,为稀硫酸时发生:Zn+H2SO4=ZnSO4+H2↑,利用极限法计算生成气体的物质的量范围.
解答:
解:n(H2SO4)=0.05L×18mol/L=0.9mol,
当全部发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O时,生成气体为0.9mol×
=0.45mol,
当全部发生:Zn+H2SO4=ZnSO4+H2↑时,生成氢气的物质的量为0.9mol,
由于两个反应都发生,故生成气体的物质的量在0.45mol和0.90mol之间,
故选C.
当全部发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O时,生成气体为0.9mol×
| 1 |
| 2 |
当全部发生:Zn+H2SO4=ZnSO4+H2↑时,生成氢气的物质的量为0.9mol,
由于两个反应都发生,故生成气体的物质的量在0.45mol和0.90mol之间,
故选C.
点评:本题考查化学方程式有关计算,明确发生的反应是关键,注意利用极限法进行解答,注意浓硫酸和稀硫酸性质的异同,难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、Na失火不能用CO2灭火,K失火也不能用CO2灭火 |
| B、Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 |
| C、将SO2通入BaCl2溶液没有白色沉淀生成,将SO2通入Ba(NO3)2溶液也没有白色沉淀生成 |
| D、工业上电解熔融MgCl2制取金属镁,也用电解熔融AlCl3的方法制取金属铝 |
下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
A、2NaCl(s)+H2SO4(浓)
| ||||
B、C+2H2SO4(浓)
| ||||
C、Cu+2H2SO4(浓)
| ||||
D、2FeO+4H2SO4(浓)
|
在25℃时,将两个铂电极插入到一定量的Na2SO4饱和溶液中电解,通电一段时间后,在阴极逸出a mol气体,同时有Wg Na2SO4.10H2O晶体析出.若温度不变,此时剩余Na2SO4溶液的质量分数为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
标准状况下2.24LCO气体在足量氧气中燃烧后,加足量的过氧化钠充分吸收气体后,过氧化钠质量增加了( )
| A、2.8g | B、4.4g |
| C、10.6g | D、1.4g |
下列不属于氧化还原反应的是( )
| A、铁与水蒸气反应 |
| B、Na2O2与水反应 |
| C、AlCl3溶液中滴加氨水 |
| D、自然界中“氮的固定” |
下列离子方程式正确的是( )
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ | ||||
| B、NO2与水的反应:3NO2+H2O=2NO3-+2H++NO | ||||
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||||
D、用铂电极电解氯化镁溶液:2Cl-+2H2O
|
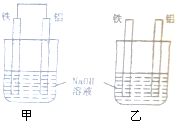 将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.
将纯铁片和纯铝片按如图方式插入同浓度的NaOH溶液中一段时间,以下叙述正确的是.| A、两烧杯中铝片表面均有气泡产生 |
| B、甲中铝片是正极,乙中铁片是负极 |
| C、两烧杯中溶液的pH均增大 |
| D、产生气泡的速度甲比乙快 |