题目内容
随着社会的发展,铅的冶炼、加工、废铅蓄电池量急剧增加等引起的铅污染应当得到重视与关注.废铅蓄电池回收铅和含铅废水的处理工艺流程如下:
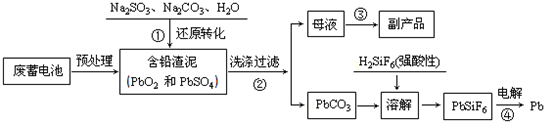
已知:Ksp(PbSO4)=1.6×10-5;Ksp(PbCO3)=3.3×10-14回答下列问题:
(1)写出步骤①转化还原提高反应速率和铅浸出率的2条措施 ;
(2)写出步骤①PbSO4转化的离子方程式 ;PbO2转化的化学方程式 ;
(3)写出步骤②证明已经洗涤干净的实验操作方法: ;
(4)步骤③从母液可获得副产品为 ;
(5)写出步骤④用惰性电极电解的阴极反应式: ;写出铅蓄电池放电时正极反应离子方程式: .

已知:Ksp(PbSO4)=1.6×10-5;Ksp(PbCO3)=3.3×10-14回答下列问题:
(1)写出步骤①转化还原提高反应速率和铅浸出率的2条措施
(2)写出步骤①PbSO4转化的离子方程式
(3)写出步骤②证明已经洗涤干净的实验操作方法:
(4)步骤③从母液可获得副产品为
(5)写出步骤④用惰性电极电解的阴极反应式:
考点:物质分离和提纯的方法和基本操作综合应用,氧化还原反应,原电池和电解池的工作原理,硫酸根离子的检验
专题:实验设计题
分析:将废蓄电池预处理,然后向含铅渣泥中加入Na2SO3、Na2CO3和H2O,Na2SO3和PbO2发生氧化还原反应生成PbSO4,因为Ksp(PbSO4)=1.6×10-5>Ksp(PbCO3)=3.3×10-14,所以PbSO4转化为PbCO3,过滤、洗涤沉淀得到PbCO3,母液中含有Na2SO4,所以可以得到副产品Na2SO4;
将PbCO3溶于强酸性H2SiF6中,得到PbSiF6,然后采用电解的方法制取Pb,
(1)步骤①转化还原提高反应速率和铅浸出率可以采用升高温度、充分搅拌等方法;
(2)PbSO4和Na2CO3反应生成溶度积常数更小的PbCO3和Na2SO4;二氧化铅具有强氧化性,Na2SO3具有还原性,二者发生氧化还原反应;
(3)如果洗涤液中不含有硫酸根离子就证明洗涤干净;
(4)Na2SO4是可溶性盐,会留在母液中;
(5)用惰性电极电解时,阴极上Pb 2+放电发生还原反应,铅蓄电池放电时,正极上二氧化铅得电子发生还原反应.
将PbCO3溶于强酸性H2SiF6中,得到PbSiF6,然后采用电解的方法制取Pb,
(1)步骤①转化还原提高反应速率和铅浸出率可以采用升高温度、充分搅拌等方法;
(2)PbSO4和Na2CO3反应生成溶度积常数更小的PbCO3和Na2SO4;二氧化铅具有强氧化性,Na2SO3具有还原性,二者发生氧化还原反应;
(3)如果洗涤液中不含有硫酸根离子就证明洗涤干净;
(4)Na2SO4是可溶性盐,会留在母液中;
(5)用惰性电极电解时,阴极上Pb 2+放电发生还原反应,铅蓄电池放电时,正极上二氧化铅得电子发生还原反应.
解答:
解:将废蓄电池预处理,然后向含铅渣泥中加入Na2SO3、Na2CO3和H2O,Na2SO3和PbO2发生氧化还原反应生成PbSO4,因为Ksp(PbSO4)=1.6×10-5>Ksp(PbCO3)=3.3×10-14,所以PbSO4转化为PbCO3,过滤、洗涤沉淀得到PbCO3,母液中含有Na2SO4,所以可以得到副产品Na2SO4;
将PbCO3溶于强酸性H2SiF6中,得到PbSiF6,然后采用电解的方法制取Pb,
(1)步骤①转化还原提高反应速率和铅浸出率可以采用升高温度、充分搅拌或增大亚硫酸钠和碳酸钠浓度等方法,故答案为:充分搅拌,适当升高温度,增大碳酸钠和亚硫酸钠浓度;
(2)Ksp(PbSO4)=1.6×10-5>Ksp(PbCO3)=3.3×10-14,所以PbSO4和Na2CO3反应生成溶度积常数更小的PbCO3,同时生成Na2SO4,离子反应方程式为CO32-+PbSO4=PbCO3+SO42-;
二氧化铅具有强氧化性,Na2SO3具有还原性,二者发生氧化还原反应,反应方程式为PbO2+Na2SO3+Na2CO3+H2O=PbCO3↓+Na2SO4+2NaOH,
故答案为:CO32-+PbSO4=PbCO3+SO42-;PbO2+Na2SO3+Na2CO3+H2O=PbCO3↓+Na2SO4+2NaOH;
(3)如果洗涤液中不含有硫酸根离子就证明洗涤干净,其检验方法为:取少量最后一次洗涤液于试管中,滴入过量盐酸再滴入少量氯化钡溶液,如果无沉淀产生,证明已经洗涤干净,故答案为:取少量最后一次洗涤液于试管中,滴入过量盐酸再滴入少量氯化钡溶液,如果无沉淀产生,证明已经洗涤干净;
(4)Na2SO4是可溶性盐,不会析出,所以会留在母液中,故答案为:Na2SO4;
(5)用惰性电极电解时,阴极上Pb 2+放电发生还原反应,电极反应式为Pb2++2e-=Pb,铅蓄电池放电时,正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,
故答案为:Pb2++2e-=Pb;PbO2+2e-+4H++SO42-=PbSO4+2H2O.
将PbCO3溶于强酸性H2SiF6中,得到PbSiF6,然后采用电解的方法制取Pb,
(1)步骤①转化还原提高反应速率和铅浸出率可以采用升高温度、充分搅拌或增大亚硫酸钠和碳酸钠浓度等方法,故答案为:充分搅拌,适当升高温度,增大碳酸钠和亚硫酸钠浓度;
(2)Ksp(PbSO4)=1.6×10-5>Ksp(PbCO3)=3.3×10-14,所以PbSO4和Na2CO3反应生成溶度积常数更小的PbCO3,同时生成Na2SO4,离子反应方程式为CO32-+PbSO4=PbCO3+SO42-;
二氧化铅具有强氧化性,Na2SO3具有还原性,二者发生氧化还原反应,反应方程式为PbO2+Na2SO3+Na2CO3+H2O=PbCO3↓+Na2SO4+2NaOH,
故答案为:CO32-+PbSO4=PbCO3+SO42-;PbO2+Na2SO3+Na2CO3+H2O=PbCO3↓+Na2SO4+2NaOH;
(3)如果洗涤液中不含有硫酸根离子就证明洗涤干净,其检验方法为:取少量最后一次洗涤液于试管中,滴入过量盐酸再滴入少量氯化钡溶液,如果无沉淀产生,证明已经洗涤干净,故答案为:取少量最后一次洗涤液于试管中,滴入过量盐酸再滴入少量氯化钡溶液,如果无沉淀产生,证明已经洗涤干净;
(4)Na2SO4是可溶性盐,不会析出,所以会留在母液中,故答案为:Na2SO4;
(5)用惰性电极电解时,阴极上Pb 2+放电发生还原反应,电极反应式为Pb2++2e-=Pb,铅蓄电池放电时,正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,
故答案为:Pb2++2e-=Pb;PbO2+2e-+4H++SO42-=PbSO4+2H2O.
点评:本题考查较综合,涉及混合物的分离和提纯、电解原理、离子检验、氧化还原反应等知识点,能从整体上分析、把握制取原理,知道亚硫酸盐和二氧化铅能发生氧化还原反应,题目难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1 mol Cl2与足量的铁反应,转移的电子数为2NA |
| B、在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| C、在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
| D、将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 NA |
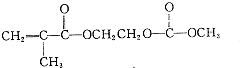
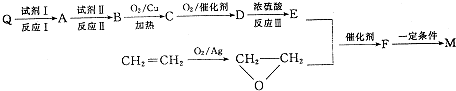
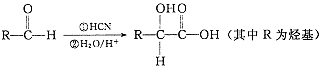
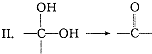
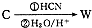 ,请写出符合下列条件的w的一种同分异构体的结构简式
,请写出符合下列条件的w的一种同分异构体的结构简式
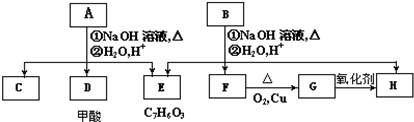
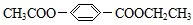 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: