题目内容
Cu2O呈红色,在酸性条件下会发生自身氧化还原反应.用H2还原CuO所得产物呈红色,若要检验其中是否含有Cu2O,以下试剂选择和判断方法均正确的是:( )
| 选项 | 试剂 | 判断方法 |
| A | 稀硝酸 | 是否生成蓝色溶液 |
| B | 稀硫酸 | 固体物质是否完全溶解 |
| C | 浓硫酸 | 是否有无色气体生成 |
| D | 稀盐酸 | 是否生成蓝色溶液 |
| A、A | B、B | C、C | D、D |
考点:铜金属及其重要化合物的主要性质,物质的检验和鉴别的基本方法选择及应用
专题:几种重要的金属及其化合物
分析:Cu2O在酸性条件下能发生自身氧化还原反应:Cu2O+2H+=Cu+Cu2++H2O,如有Cu2O,加入稀硫酸或盐酸,溶液呈蓝色,而Cu、Cu2O都与稀硝酸、浓硫酸反应,以此解答.
解答:
解:A.Cu、Cu2O都与稀硝酸反应生成硝酸铜,不能鉴别,故A错误;
B.铜和稀硫酸不反应,Cu2O在酸性条件下生成铜,不能鉴别,故B错误;
C.Cu、Cu2O都与浓硫酸反应生成二氧化硫气体,不能鉴别,故C错误;
D.加入稀盐酸,如含有Cu2O,发生Cu2O+2H+=Cu+Cu2++H2O,溶液变蓝色,可鉴别,故D正确.
故选D.
B.铜和稀硫酸不反应,Cu2O在酸性条件下生成铜,不能鉴别,故B错误;
C.Cu、Cu2O都与浓硫酸反应生成二氧化硫气体,不能鉴别,故C错误;
D.加入稀盐酸,如含有Cu2O,发生Cu2O+2H+=Cu+Cu2++H2O,溶液变蓝色,可鉴别,故D正确.
故选D.
点评:本题考查物质的检验和鉴别的设计,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性的评价,结合物质的性质解答,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原.则A、B、D、E金属活泼性由强到弱的顺序为( )
| A、A>B>E>D |
| B、A>B>D>E |
| C、D>E>A>B |
| D、D>A>B>E |
反应Cl2+H2O=HCl+HClO中,水的作用是( )
| A、作氧化剂 |
| B、作还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂也不是还原剂 |
如图是某厂采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程.该方法对H2S的吸收率达99%以上,并可制取H2和S.下列说法正确的是( )

| A、可采取在足量空气中充分燃烧的方法消除H2S的污染 |
| B、反应②中的阴极反应式为2H++2e-═H2↑,电解后所得溶液呈酸性 |
| C、如反应①中H2S过量,则反应离子方程式为:2Fe3++3H2S═2FeS↓+S↓+6H+ |
| D、此反应流程图中可循环利用的物质是FeCl3溶液,FeCl3可用作杀菌、消毒剂和净水剂 |
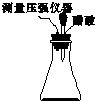 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.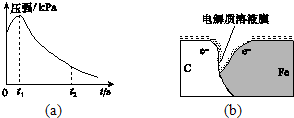 (3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二: